



Hiện nay chưa có dữ liệu thống kê chính xác có bao nhiêu quốc gia tổ chức cơ quan quản lý tương đương U.S. Food & Drug Administration (US-FDA) – Cơ quan quản lý dược phẩm, thực phẩm, mỹ phẩm và thiết bị y tế... độc lập và đầy đủ, nhưng có thể tóm tắt như sau:
US-FDA được thành lập trong khuôn khổ của Luật Thực phẩm, Dược phẩm và Mỹ phẩm (Food, Drug and Cosmetic Act) do Tổng thống Franklin D. Roosevelt ký ban hành gần một thế kỷ trước, năm 1938. US-FDA có sứ mệnh quản lý thuốc, thực phẩm, mỹ phẩm, thiết bị y tế và những sản phẩm liên quan đến sức khỏe con người, bảo đảm hiệu quả, an toàn cho người bệnh nói riêng và người tiêu dùng nói chung.
Mỗi quốc gia trên thế giới có thể có một hoặc nhiều cơ quan quản lý tương đương để đảm bảo an toàn, hiệu quả của thuốc, thực phẩm, thiết bị y tế. Ví dụ: Central Drugs Standard Control Organisation (Ấn Độ), National Medical Products Administration (Trung Quốc) là các cơ quan tương tự.
Tuy nhiên, không phải tất cả quốc gia đều có mô hình cơ quan quản lý hoàn toàn giống US-FDA về chức năng, quy mô, quyền hạn. Ví dụ, ở Việt Nam, việc quản lý dược phẩm, thực phẩm, mỹ phẩm và thiết bị y tế đang được phân tán ở nhiều cơ quan khác nhau trong Bộ Y tế như: Cục An toàn thực phẩm (thực phẩm, thực phẩm chức năng, thực phẩm bảo vệ sức khỏe), Cục Quản lý dược (thuốc, vaccine và mỹ phẩm), Cục Quản lý y dược cổ truyền (Đông dược và thuốc cổ truyền), Cục Cơ sở hạ tầng và thiết bị y tế (thiết bị, dụng cụ y tế...).
Theo Tổ chức Y tế thế giới (WHO), có 36 cơ quan quản lý (regulatory authorities) từ 34 quốc gia được công nhận là “WHO-Listed Authorities (WLA)” – là những cơ quan đạt tiêu chuẩn cao của WHO về quản lý thuốc & vaccine. Điều này không có nghĩa chỉ có 34 quốc gia có cơ quan quản lý, mà là chỉ có 34 quốc gia có cơ quan đạt tiêu chuẩn cao nhất theo WHO. Vì vậy, số quốc gia theo mô hình “cơ quan quản lý kiểu FDA” sẽ lớn hơn nhiều. Trên thế giới hiện có khoảng 100 quốc gia mà cơ cơ quan quản lý dược có tên cơ quan tương đương FDA, ví dụ EMA (Cộng đồng Châu Âu), PMDA (Nhật Bản), NMPA (Trung Quốc), ANSM (Pháp)… Dưới đây là mô hình “FDA trên thế giới” - tức là danh sách các cơ quan quốc gia quản lý dược phẩm, thực phẩm, mỹ phẩm và thiết bị y tế... tương đương với mô hình US-FDA, được chia theo khu vực. Những cơ quan có dấu sao * là những cơ quan đã đạt hoặc hoặc tiệm cận chuẩn WHO-Listed Authority (WLA).
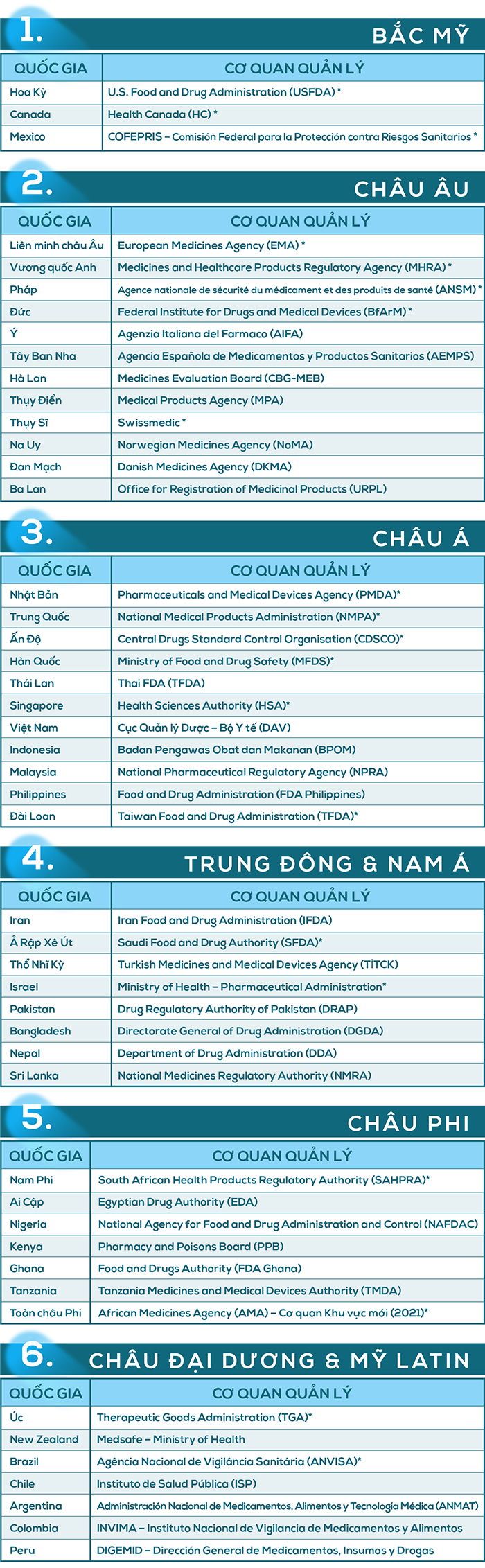
Theo bảng trên có thể thấy khoảng 100 quốc gia có cơ quan quản lý tương đương “FDA”, trong đó 34 quốc gia được WHO đánh giá đạt chuẩn cao (WLA: WHO Listed Authority) và khoảng 60–70 cơ quan khác có chức năng tương tự nhưng quy mô nhỏ hoặc đang phát triển. Các cơ quan này thường có quan hệ hợp tác với các tổ chức Hội nghị hài hòa quốc tế (Internatioal Conference of Harmonisation: ICH), Hệ thống hợp tác thanh tra dược (Pharmaceutical Inspection Co-operation Scheme:PIC/S), Tổ chức Y tế thế giới (World Health Organization: WHO) và Tổ chức đánh giá chung ASEAN (ASEAN Joint Assessment) giữa Việt Nam, Thái Lan, Singapore...

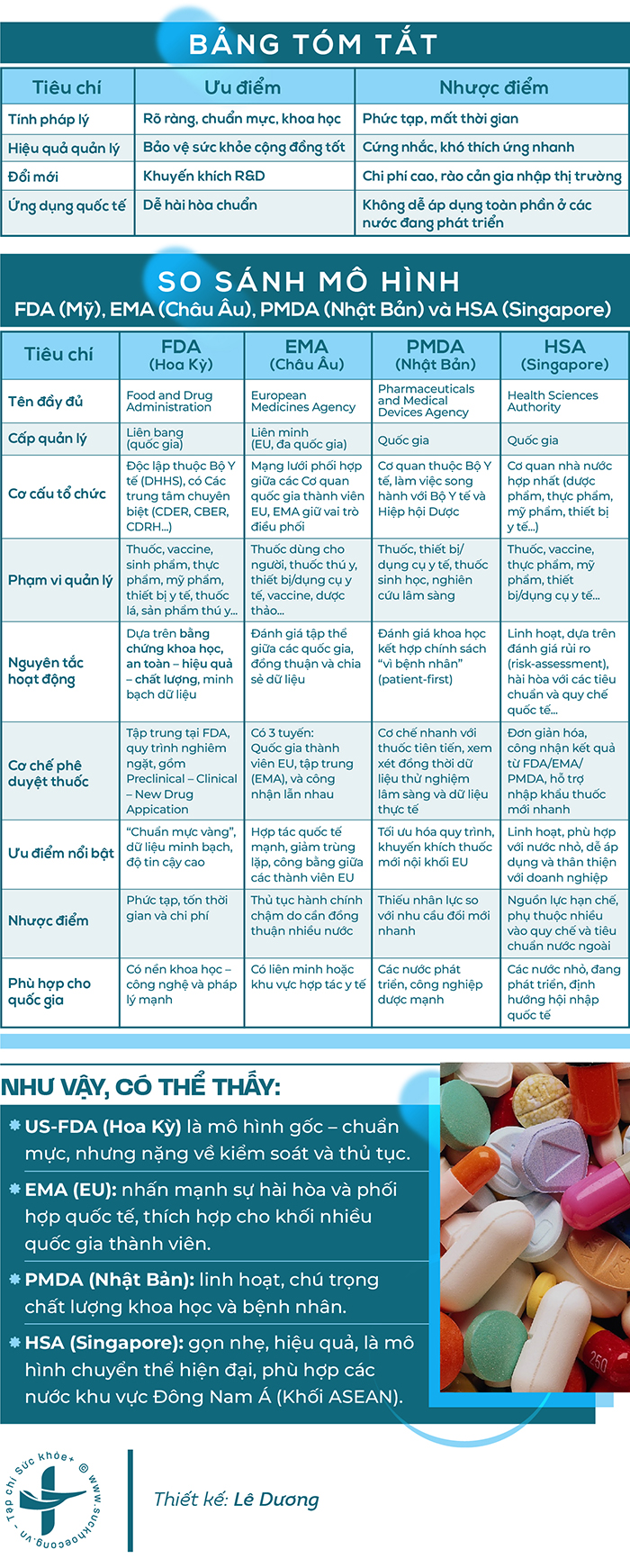
Có thể chỉ ra những ưu và nhược điểm của mô hình US-FDA mà WHO đang đánh giá cao như sau:
Về ưu điểm:
1. US-FDA có tính độc lập và minh bạch cao
• FDA là cơ quan độc lập, không phụ thuộc vào doanh nghiệp hay các nhóm lợi ích.
• Các quyết định được dựa trên bằng chứng khoa học, công khai quy trình, giúp tăng niềm tin của công chúng và người tiêu dùng.
• Tập trung quản lý vào một đầu mối tất cả các sản phẩm liên quan đến sức khỏe con người: Thuốc, vaccine, mỹ phẩm, thực phẩm nói chung và sản phẩm bảo vệ sức khỏe, thiết bị y tế, dụng cụ y tế... Do đó không tạo ra các khoảng mờ/khe hở giữa các loại đối tượng quản lý, ngăn chặn được hành vi lách luật/quy định của doanh nghiệp.
2. US-FDA có cơ sở pháp lý và quy chuẩn chặt chẽ
• Hệ thống văn bản và quy trình (GLP, GMP, GCP, GDP, GPP...) được chuẩn hóa và chi tiết.
• Hệ thống quy chế và quy định (GLP, GMP, GCP, GDP, GPP...) được chuẩn hóa và chi tiết, thường xuyên cập nhật theo các tiến bộ khoa học- kỹ thuật. US-FDA thường xuyên công bố kịp thời và cập nhật các Hướng dẫn cho doanh nghiệp (Guidance for Industry) giúp doanh nghiệp hiểu và tuân thủ các quy chế do US-FDA ban hành
• Chịu trách nhiệm trước Quốc hội và Chính phủ về việc cấp phép lưu hành thuốc, thực phẩm, mỹ phẩm, thiết bị y tế, dụng cụ y tế... từ khâu nghiên cứu đến thị trường và theo dõi hậu mãi: tác dụng phụ có hại (ADR; Adverse Drug Reaction), sự cố nghiêm trọng (SAE: Sever Adverse Event) của thuốc nói riêng và các sản phẩm sức khỏe nói chung.
• Bảo đảm chất lượng thuốc, thực phẩm, mỹ phẩm, thiết bị y tế, dụng cụ y tế... từ khâu nghiên cứu đến cấp phép lưu hành và theo dõi hậu mãi: tác dụng phụ có hại (ADR; Adverse Drug Reaction), sự cố nghiêm trọng (SAE: Sever Adverse Event) của thuốc nói riêng và các sản phẩm sức khỏe nói chung.
3. US-FDA bảo vệ sức khỏe cộng đồng hiệu quả
• FDA kiểm soát nghiêm ngặt an toàn – hiệu quả – chất lượng trước và sau khi sản phẩm ra thị trường.
• Cơ chế cảnh giác dược (pharmacovigilance) theo dõi sau lưu hành sản phẩm giúp phát hiện sớm rủi ro, thu hồi hoặc cảnh báo kịp thời.
4. US-FDA khuyến khích đổi mới, phát triển và ứng dụng khoa học – công nghệ
• Có các chương trình như xét duyệt nhanh (Fast Track), liệu pháp đột phá (Breakthrough Therapy), chỉ định thuốc hiếm (Orphan Drug Designation) để hỗ trợ nghiên cứu thuốc mới, vaccine, thuốc sinh học (biomedicines).
• Xây dựng mối quan hệ giữa đổi mới, sáng tạo và an toàn cho người bệnh.5. US-FDA có tính toàn cầu và chuẩn mực quốc tế
• Quy chuẩn FDA được xem là “tiêu chuẩn vàng” mà nhiều nước (EU, Nhật Bản, Hàn Quốc, Singapore…) học hỏi.
• Dễ dàng hài hòa với hệ thống ICH, WHO, PIC/S, giúp xuất nhập khẩu dược phẩm, thiết bị y tế thuận lợi.
Tuy nhiên, mô hình này cũng bộc lộ các nhược điểm như sau:
1. Thủ tục phức tạp, tốn thời gian và chi phí cao
• Quy trình đăng ký, thử nghiệm, phê duyệt rất nghiêm ngặt, kéo dài hàng năm.
• Gây chi phí lớn cho doanh nghiệp, đặc biệt là các công ty nhỏ hoặc công ty khởi nghiệp về y sinh học... Chi phí phê duyệt cho một thuốc mới (thuốc phát minh) có thể từ 500.000 – 1.000.000 USD, thuốc generic khoảng 200.000 USD.
2. Tính “quan liêu” và chậm thích ứng
• Do quy định quá chặt chẽ, đôi khi FDA phản ứng chậm với công nghệ mới (ví dụ cấp phép liệu pháp tế bào gốc, ứng dụng trí tuệ nhân tạo (AI) trong y học, dược học, liệu pháp gene...).
• Cần thời gian để hoàn thiện hoặc cập nhật quy chế và quy chuẩn.3. Khó áp dụng nguyên mẫu vào các nước đang phát triển
• Mô hình đòi hỏi nguồn lực mạnh, đội ngũ chuyên gia đa ngành, hệ thống kiểm nghiệm hiện đại.
• Nếu áp dụng cứng nhắc ở nước có năng lực hạn chế sẽ làm cơ quan quản lý quá tải và kém hiệu quả.
4. Áp lực pháp lý và truyền thông
• FDA chịu sức ép lớn từ dư luận, công luận, truyền thông và công nghiệp dược, đặc biệt là các tập đoàn đa quốc gia.
• Một số quyết định (như phê duyệt khẩn cấp vaccine COVID-19) đã từng gây tranh cãi.
5. Kém linh hoạt đối với tính đặc thù của các quốc gia khác
• Tiêu chuẩn FDA có thể quá cao hoặc không phù hợp, đặc biệt là về khuôn khổ luật pháp, nguồn lực tài chính, nguồn nhân lực... cũng như điều kiện thể chế chính trị, khí hậu, mô hình bệnh tật, văn hóa tiêu dùng... của các quốc gia ở các châu lục khác nhau trên thế giới.

Phần II. MÔ HÌNH QUẢN LÝ NÀO CHO VIỆT NAM?





















Bình luận của bạn