



Mô hình quản lý thực phẩm, dược phẩm, mỹ phẩm và thiết bị y tế Việt Nam hiện được phân tán cho nhiều Vụ, Cục thuộc Bộ Y tế. Phân tích ưu nhược điểm phương thức quản lý này trên các góc độ tổ chức, pháp lý, chuyên môn và hiệu quả quản lý có thể nhận xét:
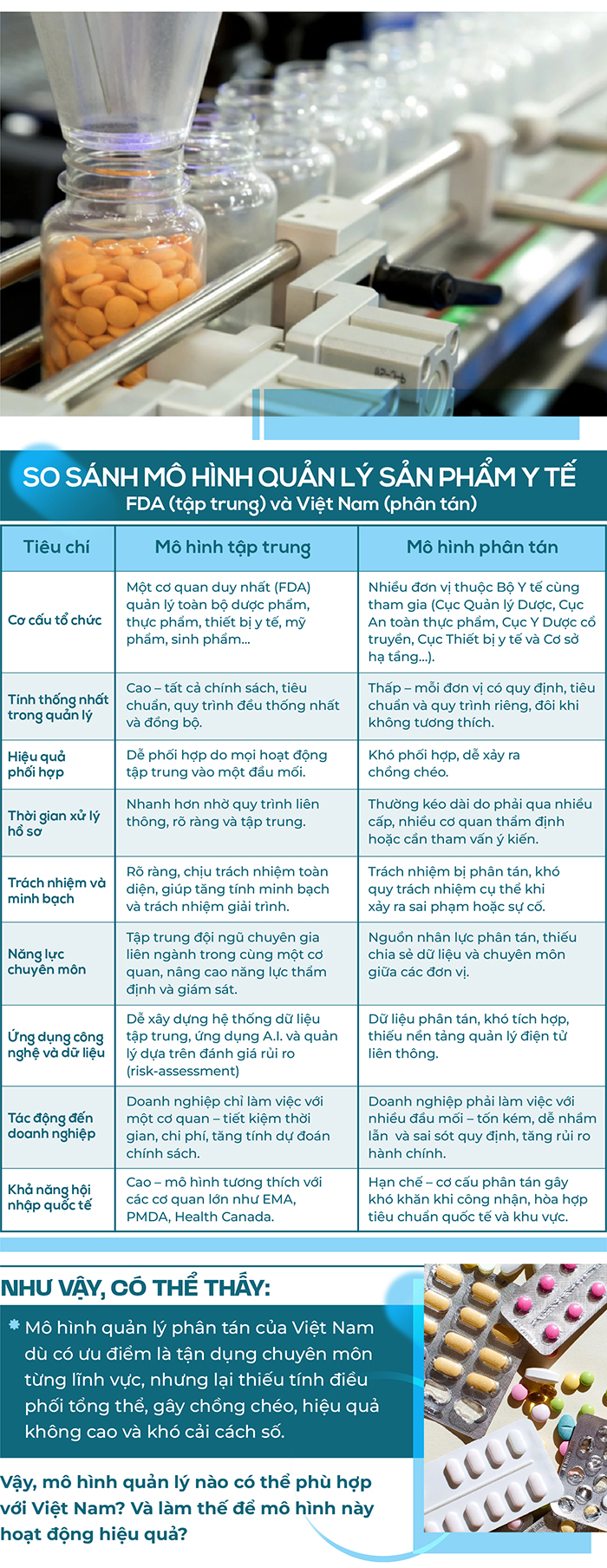
1. Chồng chéo và trùng lặp chức năng
• Các Cục, Vụ có thể cùng tham gia vào một quy trình (ví dụ: cấp giấy phép lưu hành sản phẩm, giám sát chất lượng, hậu kiểm) dẫn đến chồng chéo trách nhiệm.
• Do thiếu cơ chế phối hợp hiệu quả, việc phân định ranh giới quản lý giữa các đơn vị như Cục Quản lý Dược, Cục An toàn thực phẩm, Cục Quản lý Y dược cổ truyền, Cục Thiết bị y tế và Cơ sở hạ tầng… trở nên vừa không rành mạch vừa trùng lặp, tạo khe hở cho các doanh nghiệp không nghiêm túc lợi dụng (ví dụ giữa thuốc cổ truyền/thuốc từ dược liệu/mỹ phẩm với thực phẩm chức năng, sản phẩm bảo vệ sức khỏe...).
2. Kéo dài thời gian xử lý và ra quyết định
• Khi nhiều đơn vị cùng tham gia thẩm định hoặc phê duyệt, quy trình phải qua nhiều tầng nấc, làm tăng thời gian hành chính.
• Sản phẩm mới (thuốc, thực phẩm chức năng, thiết bị y tế…) có thể bị chậm lưu hành do phải lấy ý kiến liên lĩnh vực.3. Thiếu tính nhất quán trong quy định và tiêu chuẩn
• Mỗi đơn vị có thể áp dụng hệ tiêu chuẩn, quy định chuyên môn, quy trình xét duyệt khác nhau, không thống nhất về cách đánh giá hiệu quả và an toàn.
• Các sản phẩm cùng nhóm (ví dụ: sản phẩm bảo vệ sức khỏe, thuốc cổ truyền, mỹ phẩm) có thể chịu sự quản lý theo nhiều tiêu chí khác nhau, không rõ ràng (ví dụ thuốc cổ truyền, thuốc từ dược liệu, thực phẩm chức năng, sản phẩm bảo vệ sức khỏe...) gây khó cho doanh nghiệp hoặc để các doanh nghiệp không đứng đắn lách luật.
4. Lãng phí nguồn lực và chi phí quản lý
• Mỗi Cục, Vụ có bộ máy, nhân sự, hệ thống dữ liệu riêng, thiếu chia sẻ thông tin và liên thông cơ sở dữ liệu.
• Việc phân tán ngân sách, nhân lực và cơ sở hạ tầng gây tốn kém mà vẫn không nâng cao hiệu quả giám sát.
5. Giảm hiệu quả thanh tra, hậu kiểm
• Trách nhiệm giám sát bị phân tán, khó xác định cơ quan chịu trách nhiệm chính khi xảy ra vi phạm hoặc sự cố y tế.
• Hậu kiểm yếu, khó xử lý triệt để các vấn đề về chất lượng, sai phạm quảng, an toàn người dùng.
6. Ảnh hưởng đến minh bạch và niềm tin của doanh nghiệp nghiêm túc
• Doanh nghiệp có thể phải qua nhiều cơ quan quản lý khác nhau cho cùng một sản phẩm, tăng chi phí tuân thủ, rủi ro về hành chính.
• Thiếu đầu mối thống nhất làm giảm tính minh bạch và tính dự đoán được của chính sách quản lý, gây lãng phí “cơ hội” cho doanh nghiệp.
7. Khó xây dựng hệ thống quản lý hiện đại, theo chuẩn quốc tế (như US-FDA, EU-EMA) và tương đồng trong khu vực (Ví dụ: FDA Thái Lan, Lào, Campuchia...)
• Các cơ quan quốc tế như FDA (Mỹ) hay EMA (Châu Âu) hoạt động theo mô hình tập trung, chuyên môn hóa cao, đảm bảo tính đồng nhất và minh bạch.
• Trong khi đó, mô hình phân tán ở Việt Nam khó tích hợp dữ liệu, khó số hóa quy trình, và hạn chế khả năng hội nhập quốc tế và ngay cả trong khu vực ASEAN
1. Thành lập cơ quan quản lý thống nhất, ví dụ “Cơ quan Quản lý Dược phẩm – Thực phẩm Việt Nam” (Vietnam Drug and Food Administration: VDFA) hoặc “Cơ quan Quản lý Dược phẩm, Thực phẩm và Thiết bị y tế Việt Nam” (Vietnam Drug, Food and Medical Device Administration: VDFMDA)
• Gộp các chức năng quản lý các nhóm sản phẩm liên quan đến sức khỏe (health products) đang phân tán ở các Cục hiện nay (Cục Quản lý Dược, Cục An toàn thực phẩm, Cục Thiết bị y tế và Cơ sở hạ tầng, Cục Quản lý Y Dược cổ truyền…) thành một cơ quan quản lý chuyên trách tập trung, duy nhất trực thuộc Bộ Y tế.
• Cơ quan này chịu trách nhiệm về toàn bộ vòng đời sản phẩm liên quan đến sức khỏe: nhận và xét duyệt hồ sơ, cấp giấy phép lưu hành, quản lý chất lượng, quảng cáo, giám sát hậu mãi, hậu kiểm chất lượng và thu hồi giấy phép lưu hành (khi cần).
2. Xây dựng khung pháp lý đồng bộ, thống nhất
• Trên cơ sở Luật Dược, Luật An toàn thực phẩm... và các văn bản dưới luật như Nghị định của Chính phủ, Quyết định của Thủ tướng Chính phủ... xây dựng “Luật Quản lý sản phẩm y tế – sức khỏe”, làm cơ sở pháp lý thống nhất quản lý các nhóm sản phẩm liên quan đến sức khỏe (thuốc, thuốc sinh học và sinh học tương tự, vaccine, thực phẩm, thực phẩm chức năng, thực phẩm bảo vệ sức khỏe, mỹ phẩm, thiết bị và dụng cụ y tế...)
• Tăng cường hài hòa với chuẩn quốc tế (FDA, EMA, WHO, PIC/S) và thúc đẩy tiến trình công nhận lẫn nhau với các Cơ quan Quản lý dược chặt chẽ (SRA: Stringent Regulatory Authority) thúc đẩy quá trình công nhận lẫn nhau và hợp tác quốc tế, tạo thuận lợi cho xuất khẩu các sản phẩm sức khỏe của Việt Nam.
3. Hiện đại hóa hệ thống quản lý – chuyển đổi số toàn diện
• Xây dựng hệ thống cơ sở dữ liệu quốc gia về sản phẩm sức khỏe, tích hợp toàn bộ quy trình từ nộp hồ sơ – thẩm định – cấp phép và hậu kiểm.
• Đẩy mạnh ứng dụng Khoa học dữ liệu (DS: Data Science), Trí tuệ nhân tạo (AI: Arteficial Intelligence), Chuỗi khối (Blockchain) và Dữ liệu lớn (BD: Big Data) trong đánh giá nguy cơ (risk assessment), phát hiện gian lận thương mại và giám sát chất lượng hậu mãi.
4. Tăng cường năng lực chuyên môn và minh bạch hóa hoạt động
• Đào tạo, thu hút đội ngũ chuyên gia đa ngành: dược học, y học, sinh học, công nghệ thông tin, tin sinh học (bioinformatic), pháp lý, kinh tế y tế...
• Công khai hóa toàn bộ quy trình cấp phép, kết quả thẩm định và quyết định quản lý để các Bộ, Ngành liên quan, doanh nghiệp, người dân và người tiêu dùng dễ dàng theo dõi và giám sát.
5. Tăng cường phối hợp liên ngành và hợp tác quốc tế
• Phối hợp chặt chẽ giữa Bộ Y tế, Bộ Khoa học và Công nghệ, Bộ Công Thương, Bộ Nông nghiệp và Môi trường... trong kiểm nghiệm, kiểm định, ban hành tiêu chuẩn và thương mại hóa sản phẩm.
• Ký kết các thỏa thuận công nhận quy chế và tiêu chuẩn song phương trong khu vực ASEAN, tiến tới công nhận tương đương trước hết với PIC/S và sau đó với EMA, US-FDA.
6. Lợi ích kỳ vọng của các mô hình đề xuất

Tóm lại, mô hình “Cơ quan Quản lý Dược phẩm - Thực phẩm Việt Nam” (VDFA: Vietnam Drug and Food Administration) hoặc “Cơ quan Quản lý Dược phẩm, Thực phẩm, Thiết bị y tế Việt Nam” (VDFMDA: Vietnam Drug, Food and Medical Device Administration) không chỉ là cải cách về cơ cấu tổ chức, mà có thể là bước chuyển chiến lược để Việt Nam xây dựng một hệ thống quản lý các sản phẩm liên quan đến sức khỏe hiện đại, minh bạch, dựa trên khoa học và dữ liệu, đáp ứng yêu cầu hội nhập và bảo vệ sức khỏe cộng đồng trong kỷ nguyên mới.























Bình luận của bạn