
Xử phạt công ty sản xuất 2 lô thuốc kháng sinh Zinnat kém chất lượng
2 doanh nghiệp bán hàng đa cấp bị xử phạt hơn 400 triệu đồng
Cục Quản lý Dược thu hồi toàn quốc lô sản phẩm Dầu gội đầu Newgi.C
Thu hồi Giấy chứng nhận đủ điều kiện kinh doanh dược của Công ty TNHH Allegens
Mới đây, Công ty Zhejiang Xianju Pharmaceutical Co., Ltd. có Văn thư gửi Cục Quản lý Dược phản ánh về việc 2 lô nguyên liệu Methylprednisolone trên nhãn ghi: số lô: 04.1064-191204 và số lô: 04.1064-220107, nhà sản xuất Zhejiang Xianju PharmaceuticalCo., Ltd. đã nhập khẩu và sử dụng tại Việt Nam. Văn thư khẳng định: Thực tế, nguyên liệu này không phải là sản phẩm của Công ty Zhejiang Xianju Pharmaceutical Co., Ltd. sản xuất.
Ngày 26/8/2022, Công ty TNHH MTV Anpharma và Công ty TNHH Hóa dược Hoài Phương cũng có Văn thư gửi Cục Quản lý Dược báo cáo: Công ty Bear Hill Co. Ltd nhận trách nhiệm về việc nguồn gốc 2 lô nguyên liệu Methylprednisolone ghi trên nhãn: số lô: 04.1064-191204 và số lô: 04.1064-220107, nhà sản xuất Zhejiang Xianju PharmaceuticalCo., Ltd. nêu trên đúng là không phải sản phẩm của Công ty Zhejiang XianjuPharmaceutical Co., Ltd. sản xuất.
Sau đó, 4 công ty: Công ty CPDP Trung ương I – Pharbaco; Công ty CP USPharma USA; Công ty CPDP Quảng Bình; Công ty CPDP Tipharco cũng đã gửi báo cáo đến Cục Quản lý Dược về việc sản xuất các lô thuốc từ 2 lô nguyên liệu Methylprednisolone có thông tin trên nhãn nêu trên.
Căn cứ vào các Văn thư, báo cáo trên và các quy định về quản lý dược hiện hành của Việt Nam, Cục Quản lý Dược ra Công văn số 9343/QLD-CL ngày 22/9/2022 về việc thông báo thu hồi toàn quốc đối với toàn bộ các lô thuốc đã được sản xuất từ 2 lô nguyên liệu Methylprednisolone có thông tin trên nhãn nêu trên:
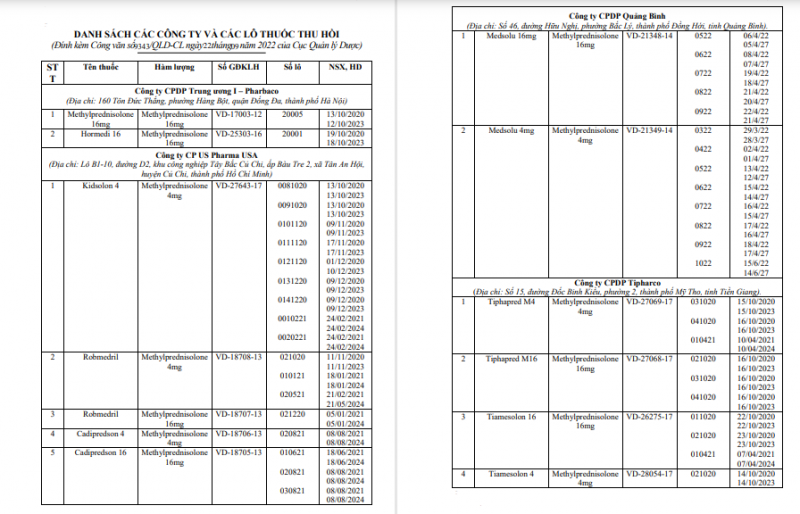
Danh sách các công ty và các lô thuốc thu hồi theo Công văn của Cục Quản lý Dược
Trong thời hạn 2 ngày, các cơ sở sản xuất thuốc phối hợp với các nhà cung cấp và phân phối thuốc phải gửi thông báo thu hồi tới các cơ sở bán buôn, bán lẻ, sử dụng và tiến hành thu hồi toàn bộ các lô thuốc trong danh sách nêu trên; Gửi báo cáo thu hồi về Cục Quản lý Dược trong vòng 18 ngày kể từ ngày ký Công văn này.
Sở Y tế các tỉnh thành phố trực thuộc Trung ương, Y tế các ngành thông báo cho các cơ sở kinh doanh, sử dụng thuốc thu hồi các lô thuốc không đúng qui định nêu trên; Công bố thông tin về quyết định thu hồi thuốc trên Trang thông tin điện tử của Sở; Kiểm tra và giám sát các đơn vị thực hiện thông báo này; Xử lý những đơn vị vi phạm theo quy định hiện hành; Báo cáo về Cục Quản lý Dược và các cơ quan chức năng có liên quan.
Các Sở Y tế có cơ sở sản xuất thuốc đóng trên địa bàn kiểm tra và giám sát cơ sở sản xuất thuốc thực hiện việc thu hồi và xử lý thuốc bị thu hồi theo quy định.




























Bình luận của bạn