 BV Chợ Rẫy đã sử dụng hàng nghìn hộp thuốc bị dán đè nhãn cho bệnh nhân từ năm 2012, đến nay mới bị phát hiện
BV Chợ Rẫy đã sử dụng hàng nghìn hộp thuốc bị dán đè nhãn cho bệnh nhân từ năm 2012, đến nay mới bị phát hiện
Thu hồi 70.000 lọ thuốc chống trầm cảm kém chất lượng
Quản lý sản xuất thuốc còn nhiều lỗ hổng
Dùng thuốc điều chỉnh rối loạn mỡ máu kéo dài có hại không?
Tăng thuế thuốc lá, rượu bia sợ buôn lậu gia tăng?
Thuốc triệt sản ở Ấn Độ chứa độc chất diệt chuột
Cụ thể, hàng nghìn hộp thuốc Oxaliplatin Hospira (loại 50 mg và 100 mg), Calcium folinate (loại 50 mg và 100 mg) nhập vào Việt Nam, đấu thầu vào bệnh viện (BV), được sử dụng từ năm 2012 đến nay mới bị phát hiện nơi sản xuất bị dán đè nhãn lên thành nơi sản xuất khác.
Nơi sản xuất: Từ Anh sang Australia
Một bệnh nhân đến BV Chợ Rẫy khám và điều trị, được nơi đây bán theo toa hộp thuốc Oxaliplatin Hospira. Bệnh nhân thấy một mảnh giấy nhỏ dán đè lên ngoài vỏ hộp, trên ghi nhà sản xuất “Hospira Australia Pty Ltd”. Tò mò, bệnh nhân lột mảnh giấy thì thấy dòng chữ trên hộp ghi nhà sản xuất “Hospira UK Limited”. Lọ thuốc bên trong cũng bị “đè nhãn” thay đổi nơi sản xuất như vậy.
“Thuốc bị “đè nhãn” để đổi tên nơi sản xuất từ Anh sang Australia liệu có là hợp lệ?” - bệnh nhân này thắc mắc. “Vì sao phải “đè nhãn”, chất lượng thuốc có vấn đề gì không vì đây là thuốc khá đắt tiền trị ung thư”.
Từ phản ánh trên, phóng viên tìm hiểu thì được biết thuốc Oxaliplatin Hospira (50 mg và 100 mg) là thuốc hóa trị ung thư được Công ty Dược Nam Linh (quận 7) nhập về, đấu thầu và trúng thầu tại BV Chợ Rẫy từ năm 2012. Ngoài BV Chợ Rẫy thì BV Ung bướu, Bình Dân, BV 115 (TP.HCM), BV Trung ương Huế… cũng mua sử dụng Oxaliplatin Hospira của Công ty Nam Linh theo kết quả đấu thầu của BV Chợ Rẫy.
Năm 2014, kết quả thầu tập trung tại Sở Y tế TP.HCM, Công ty Nam Linh cũng đã trúng thầu hơn 10.000 lọ thuốc này (1,8 triệu đồng/lọ 50 mg).
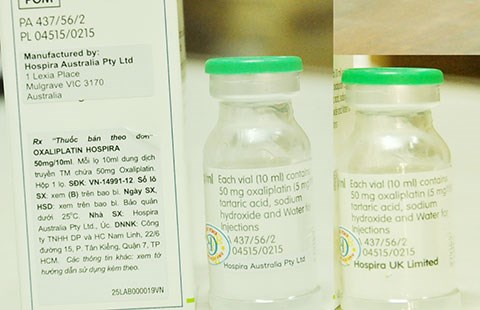
Hộp thuốc Oxaliplatin Hospira bị “đè nhãn”. Lọ thuốc bên trong cũng bị “đè nhãn”, lột lớp nhãn thì xuất hiện nơi sản xuất khác. Ảnh: TÙNG SƠN
Kiểm tra thực tế cho thấy trên bao bì và lọ thuốc đều có mảnh giấy dán đè lên ghi chữ “Hospira Australia Pty Ltd”, khi lột mảnh giấy này ra thì phía dưới có chữ “Hospira UK Limited”.
BV dùng thuốc nhưng không phát hiện
Tuy thuốc trúng thầu vào BV Chợ Rẫy từ năm 2012 nhưng Dược sỹ Nguyễn Quốc Bình - Trưởng khoa Dược BV Chợ Rẫy cho biết từ đầu tháng 10/2014, BV mới phát hiện việc “đè nhãn” của hộp và lọ thuốc. BV đã yêu cầu nhà cung cấp là Công ty Nam Linh làm rõ.
Theo Dược sỹ Bình, theo quy trình khi nhập thuốc thì phải mở hộp ra xem có gì bất thường không; đối chiếu lô, hạn dùng… nhưng từ đầu BV không phát hiện được vấn đề “đè nhãn”. Công ty Nam Linh cũng không thông báo cho BV. “Trở lại cái văn hóa công ty, có đơn vị thông báo tất cả dù có thay đổi một chút, có đơn vị BV yêu cầu mới giải trình, chỗ khác hỏi nhưng im luôn” - dược sĩ Bình trần tình.
Dược sỹ Bình cũng cho biết thêm mỗi năm BV xài khoảng 5.000-6.000 lọ Oxaliplatin Hospira. Hiện BV Chợ Rẫy còn 400 lọ thuốc Oxaliplatin Hospira 50 mg/10 ml và một số lọ Calcium folinate 50 mg (trị ngộ độc, cũng bị “đè nhãn”).
“Đè nhãn” mới đủ cung ứng
Giải thích với phóng viên, Dược sỹ Trịnh Thị Hồng - Giám đốc Công ty Nam Linh, cho biết hai sản phẩm Oxaliplatin Hospira và Calcium folinate do số lượng đặt hàng ít, không đủ một mẻ (50.000 lọ) nên công ty nhập không nhiều, có loại chỉ bán 7.000 lọ/năm. Ngoài ra, hạn sử dụng của thuốc cũng ngắn (18 tháng) nên không dám nhập nhiều vì sợ hết hạn. Nên khi trúng thầu số lượng nhiều, nhà sản xuất ở Australia phải ghép lô thuốc với lô sản xuất ở Anh mới cung ứng đủ.
Về việc ai dán đè nhãn và dán ở đâu, bà Hồng nói nếu thị trường Việt Nam cần gấp thì sẽ “đè nhãn” tại nhà sản xuất ở Australia. Trường hợp không gấp thì việc này sẽ làm tại nhà phân phối (Zuellig Pharma) ở Singapore trước khi về Việt Nam. Bà Hồng khẳng định Công ty Nam Linh không tham gia trong quá trình “đè nhãn” này.
Về sản phẩm và nhãn sản phẩm, theo bà Hồng, công ty đã đăng ký ở Cục Quản lý dược và được Cục cấp số đăng ký và được thông quan qua cửa khẩu sân bay Tân Sơn Nhất. Tuy nhiên, bà Hồng nhìn nhận là công ty không nói cho Cục Quản lý dược biết là có sự “đè nhãn” này vì Cục… không yêu cầu.
Trả lời câu hỏi vì sao không “đè nhãn” nơi sản xuất tại Anh mà tại Australia, bà Hồng nói: “Tại trong hồ sơ mời thầu chỉ yêu cầu nhà sản xuất mà bản chất là nhà sản xuất ở đây là Australia chứ không phải Anh”.




























Bình luận của bạn