
Từ 1957 đến 1961, thuốc đã gây ra tình trạng dị dạng chân tay cho hàng ngàn trẻ em trên toàn thế giới. Nguyên nhân của thảm họa này là do nhà sản xuất đã không tiến hành đầy đủ các thử nghiệm để đánh giá sự an toàn của thuốc trước khi phát hành. Cơn ác mộng thalidomide đã trở thành một trong những giai đoạn đen tối nhất trong lịch sử ngành Dược. Bài viết này sẽ cung cấp một cái nhìn ngắn gọn về lịch sử của thuốc và các bài học kinh nghiệm rút ra từ thảm kịch.
Nghiên cứu và đưa thalidomide ra thị trường
Theo tài liệu “Bảo vệ sức khỏe Mỹ: FDA, Kinh doanh, và Quy chế ” của Philip J. Hilts (New York: Alfred A. Knopf, 2003), hãng dược phẩm Đức Chemie Grünenthal giới thiệu thalidomide lần đầu tiên – dưới tên thương mại Contergan – tại thị trường Đức vào ngày 1 tháng Mười, 1957, như là một thuốc an thần để điều trị chứng mất ngủ cũng như giảm chứng buồn nôn do thai nghén. Đến năm 1960, thuốc được bán rộng rãi trên hơn 20 quốc gia ở châu Âu và châu Phi.
Tại thời điểm phát triển của loại thuốc này, các nhà khoa học không tin bất kỳ loại thuốc nào dùng cho phụ nữ mang thai có thể vượt qua hàng rào nhau thai và gây tổn hại cho bào thai đang phát triển.

Ảnh minh họa
Những nghi ngờ đầu tiên và thảm kịch
Đầu những năm 1960 các bác sĩ bắt đầu lo ngại về tác dụng phụ của Thalidomide. Một số bệnh nhân có tổn thương thần kinh ở chân tay sau khi sử dụng lâu dài. Đồng thời có sự gia tăng tỉ lệ sinh trẻ em khuyết tật ở Đức và các nơi khác. Tuy nhiên, không có cáo buộc sự liên quan của thalidomide với hiện tượng này. Cho đến năm 1961, khi công trình nghiên cứu tiến hành độc lập bởi nhà khoa học Đức Widukind Lenz và Úc William McBride được công bố, thuốc đã bị rút ra khỏi thị trường. Tuy vậy, lúc này đã quá muộn đối với nhiều người.

Ảnh minh họa
Từ 1956 đến 1962, khoảng 10.000 trẻ em được sinh ra với dị tật nghiêm trọng, bao gồm cả quái thai ngắn chi, do mẹ đã sử dụng thalidomide trong quá trình mang thai. Người ta không biết chính xác có bao nhiêu nạn nhân trên toàn thế giới do thuốc gây ra, mặc dù theo ước tính con số này nằm trong khoảng từ 10.000 đến 20.000.
Ở Anh, loại thuốc này đã được cấp phép vào năm 1958.

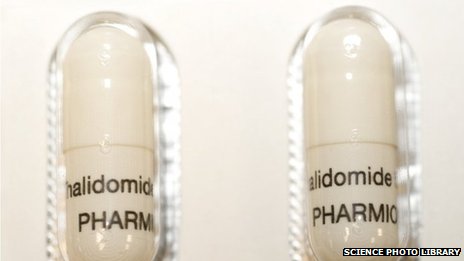
Thuốc Thalidomide. Ảnh nguồn Internet
Trong số 2.000 trẻ em sinh ra bị dị tật bẩm sinh
khoảng một nửa đã chết trong vòng vài tháng và 466 sống sót tính đến năm 2010.
Tại Mỹ, nhà dược lý
học, tiến sĩ Frances Oldham Kelsey, làm việc tại Cục quản lý thuốc và dược phẩm
Hoa Kỳ, bất chấp những áp lực (từ) công ty Richardson-Merrell, đã từ chối
cấp phép lưu hành thalidomide trên thị trường Mỹ. Điều này làm giảm ảnh hưởng
của thalidomide tại quốc gia này. Tuy nhiên, hàng triệu viên thuốc đã được phân
phối cho các bác sĩ trong một chương trình thử nghiệm lâm sàng. Do đó không thể
biết có bao nhiêu phụ nữ mang thai đã được cho(kê đơn) thuốc để giúp làm giảm
bớt tình trạng ốm nghén hoặc (sử dụng) như là một thuốc an thần.
Thuốc đã được thu hồi trong năm 1961 tại Vương quốc Anh. Canada là quốc gia cuối cùng ngăn chặn việc bán thuốc, vào đầu năm 1962.
Sau thảm kịch
Năm 1962, Kelsey đãđược Tổng thống John F. Kennedy trao tặng giải thưởng cho đóng góp dân sự tiêu biểu toàn liên bang vì sự đấu tranh dũng cảm của bà góp phần ngăn chặn thảm họa thalidomide xảy ra tại Mỹ.

Năm 1968, sau một chiến dịch lâu dài do tờ Sunday Times khởi xướng, các nạn nhân ở Anh đã giành được thỏa thuận bồi thường của hãng Distillers, công ty đã phân phối thalidomide ở nước này. Tại Melbourne, một phụ nữ tên Lynette Rowe, người sinh ra không có chân tay, đã dẫn đầu một vụ kiện nhà sản xuất thuốc, Grünenthal. Ngày 17 Tháng 7 năm 2012, Lynette Rowe đã đạt được thỏa thuận kết thúc vụ kiện được cho là trị giá hàng triệu đô la và mở đường cho các nạn nhân khác nhận được bồi thường.
Ngày 31/8/2012, Giám đốc điều hành của Grünenthal Harold Stockđã lần đầu tiên lên tiếng xin lỗi vì đã cho phép lưu hành thuốc và trốn tránh trách nhiệm trong suốt thời gian qua.Tuy vậy những người ủng hộ các nạn nhân cảm thấy lời xin lỗi là “xúc phạm” và “quá ít, quá muộn”, và chỉ trích công ty đã không chịu bồi thường. Họ tỏ ra không hài lòng với lời tuyên bố rằng vào thời điểm đó không ai có thể biết trước thảm họa sẽ xảy ra.

Thắt chặt luật quản lý Dược
Ngày 10/10/1962, Tổng thống Kennedy đã thông qua đạo luật thường được gọi là sửa đổi Kefauver-Harris vào ngày 10/10/1962. Đạo luật mang tính cột mốc đã cải tiến Luật liên bang về quản lý các thực phẩm, thuốc và mỹ phẩm năm 1938, tăng cường kiểm soát của FDA đối với các thử nghiệm thuốc trên người và thay đổi cách thức quy định các loại thuốc mới.
Theo luật 1938, các nhà sản xuất thuốc chỉ cần cho thấy rằng thuốc của họ an toàn. Theo Luật năm 1962, lần đầu tiên, họ còn phải chứng minh rằng tất cả các loại thuốc mới có hiệu quả. Luật bổ sung năm 1962 còn đòi hỏi phải có sự đồng ý từ các bệnh nhân tham gia trong các nghiên cứu thử nghiệm thuốc, và các công ty dược được yêu cầu báo cáo với FDA về bất kỳ phản ứng bất lợi nào của thuốc trên bệnh nhân.
Thalidomide ngày nay
Thalidomide chưa bao giờ biến mất. Kể từ khi bị phát hiện nguy cơ gây ra các dị tật bẩm sinh, thuốc vẫn tiếp tục được nghiên cứu trên khắp thế giới để điều trị ung thư và các tình trạng bệnh lý nghiêm trọng khác. Vào năm 1998, FDA lần đầu tiên chấp thuận lại thalidomide dưới tên thương mại Thalomid ® , sản xuất bởi công ty Celgene với một chỉ định duy nhất cho bệnh hồng ban nút phong (ENL), một biến chứng nặng của bệnh phong (bệnh Hansen).
Do lo ngại về nguy cơ gây quái thai, FDA đã kiểm soát việc lưu hành thalidomide ở Hoa Kỳ thông qua chương trình Giáo dục hệ thống và Kê đơn an toàn Thalidomide (S.T.E.P.S ®). Quy trình này giám soát chặt chẽ bệnh nhân, việc kê đơn và các hiệu thuốc, mở rộng giáo dục về an toàn Thalidomide nhằm tránh tác hại của thuốc trong thời kỳ mang thai.
Thalidomide tiếp tục được nghiên cứu trong sự kiểm soát nghiêm ngặt của FDA. Thuốc ức chế sự tăng trưởng của các mạch máu mới trong các khối u, hứa hẹn điều trị u đa tủy nguyên phát (một dạng ung thư tủy xương) và ung thư Kaposi (một bệnh ung thư liên quan đến AIDS). Thalidomide cũng đã cho thấy tiềm năng điều trị các khối u rắn trong tuyến tiền liệt và não, cũng như các biến chứng của cấy ghép tủy xương. Ngày 26 tháng 5 năm 2006, FDA đã đồng ý mở rộng chỉ định cho THALOMID ®, dùng kết hợp với dexamethasone để điều trị đa u đa tủy nguyên phát ở bệnh nhân mới phát hiện.
Việc sử dụng lại thalidomide vẫn còn gây tranh cãi.Các tác động tích cực là không thể phủ nhận.nhưng lại tiềm tàng một nguy cơ xuất hiện những ca dị tật mới do thalidomide, đặc biệt là ở các quốc gia mà hệ thống quản lý thuốc còn yếu kém. Thị trường chợ đen mua bán trái phép của bệnh nhân phong càng làm dấy lên nhiều lo ngại “Chúng ta cần phải có biện pháp phòng ngừa thận trọng,” Frances Oldham Kelsey nói, “bởi vì người ta quên đi nỗi đau rất nhanh”.























Bình luận của bạn