 Cục Quản lý Dược (Bộ Y tế) yêu cầu thu hồi, tiêu hủy trên toàn quốc đối với hàng loạt sản phẩm mỹ phẩm vi phạm nghiêm trọng về chất lượng, nguồn gốc và ghi nhãn - Ảnh: Cục Quản lý Dược.
Cục Quản lý Dược (Bộ Y tế) yêu cầu thu hồi, tiêu hủy trên toàn quốc đối với hàng loạt sản phẩm mỹ phẩm vi phạm nghiêm trọng về chất lượng, nguồn gốc và ghi nhãn - Ảnh: Cục Quản lý Dược.
17 sản phẩm TPBVSK bị thu hồi giấy công bố sản phẩm
Vụ phòng khám “ma” lừa đảo 123 triệu đồng, Bộ Y tế nói gì?
Thu hồi 2 lô dầu gội “trị chấy” chứa chất diệt côn trùng
Thu hồi giấy công bố sản phẩm đối với 2 Thực phẩm bảo vệ sức khỏe
Theo đó, hai sản phẩm kem chống nắng gồm Kem chống nắng Vitamin C (số tiếp nhận phiếu công bố mỹ phẩm 242/24/CBMP-PT) của Công ty TNHH SX và TM Athena Việt Nam (Phú Thọ) và Kem chống nắng Sun Cream (số tiếp nhận phiếu công bố mỹ phẩm 39/22/CBMP-PT) của Công ty TNHH Mỹ phẩm Lovis (Quảng Ninh) bị kết luận là “hàng giả” khi mẫu kiểm nghiệm cho kết quả chỉ số chống nắng SPF chỉ đạt dưới 70% so với công bố trên bao bì. Kết luận được đưa ra dựa trên kết quả giám định của Viện Khoa học hình sự Bộ Công an.
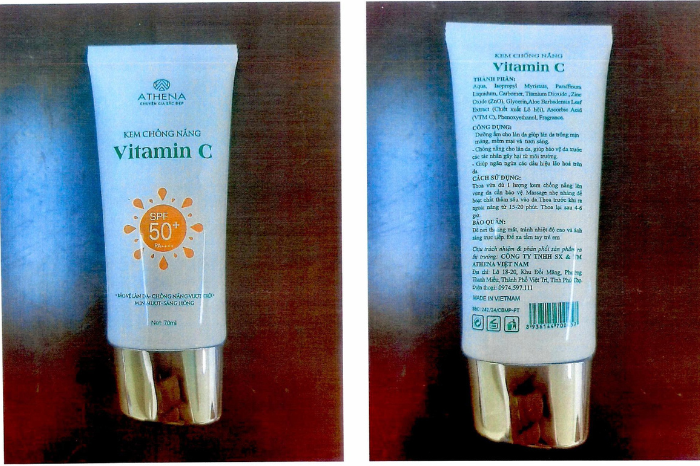
Sản phẩm kem chống nắng vitamin C của Athena bị thu hồi - Ảnh: Cục Quản lý Dược.

Hình ảnh sản phẩm kem chống nắng Sun Cream bị thu hồi - Ảnh: Cục Quản lý Dược.
Bên cạnh đó, sản phẩm Vitamin E Mosturising Cream Enriched with Sunflowers Oil, trên nhãn ghi “Product of Thailand”, được phát hiện bày bán tại một số nhà thuốc trên địa bàn Hà Nội cũng bị yêu cầu thu hồi và tiêu hủy. Sản phẩm này không có nhãn phụ tiếng Việt, không rõ cơ sở chịu trách nhiệm đưa ra thị trường, chưa được cấp số tiếp nhận phiếu công bố sản phẩm mỹ phẩm nhập khẩu, đồng thời không đạt chất lượng về giới hạn vi sinh vật và không phát hiện thành phần vitamin E như công bố.
Cục Quản lý Dược yêu cầu Sở Y tế các địa phương thông báo, kiểm tra, giám sát việc thu hồi các sản phẩm; đồng thời tuyên truyền để người dân không mua, bán, sử dụng các sản phẩm vi phạm nói trên. Các đơn vị liên quan phải gửi báo cáo thu hồi, xử lý về Cục Quản lý Dược.
Cùng ngày, Cục Quản lý Dược cũng có quyết định thu hồi giấy đăng ký lưu hành và thu hồi bắt buộc toàn bộ các lô thuốc đối với thuốc Femancia, số đăng ký VD-27929-17, do Công ty Cổ phần Dược phẩm Me Di Sun, địa chỉ: 521 Khu phố An Lợi, Phường Hòa Lợi, Thành phố Hồ Chí Minh (địa chỉ cũ: 521 Khu phố An Lợi, Phường Hòa Lợi, Thị xã Bến Cát, Tỉnh Bình Dương) sản xuất.
Thuốc Femancia là viên nang cứng, chứa Sắt fumarat 305 mg và Acid Folic 350 mcg, được giới thiệu là thuốc bổ sung sắt, dùng trong điều trị và dự phòng thiếu máu thiếu sắt.
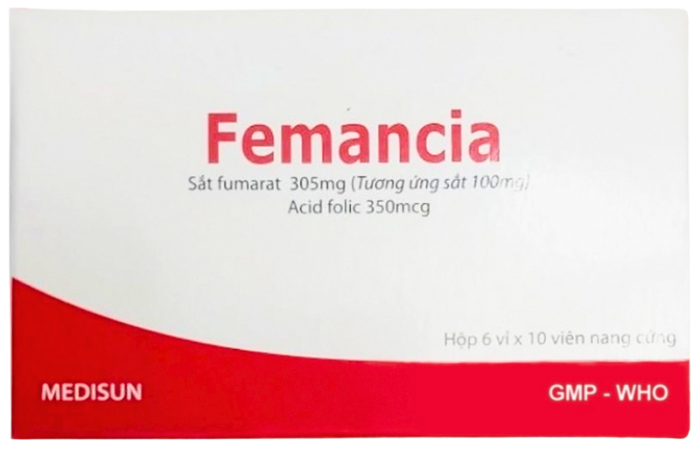
Tháng 3/2025, Cục Quản lý Dược thông báo thu hồi hai lô thuốc Viên nang cứng Femancia, có số đăng ký lưu hành VD-27929-17 (Lô số 031222, ngày sản xuất 2/12/2022, hạn dùng 2/12/2025 và lô số 020223, ngày sản xuất 21/2/2023, hạn dùng 21/2/2026) do không đạt tiêu chuẩn chất lượng về chỉ tiêu định lượng, độ hòa tan, vi phạm mức độ 2 - Ảnh: Nhà thuốc Long Châu.
Theo Cục Quản lý Dược, thuốc Femancia bị thu hồi theo quy định tại điểm b khoản 1 Điều 58 Luật Dược (Trong thời hạn 60 tháng có 02 lô thuốc bị thu hồi bắt buộc do vi phạm ở mức độ 2 hoặc 03 lô thuốc trở lên vi phạm chất lượng).
Cục yêu cầu công ty sản xuất phải thu hồi toàn bộ thuốc trong vòng 15 ngày kể từ ngày quyết định có hiệu lực, đồng thời yêu cầu Sở Y tế các tỉnh, thành phố kiểm tra, giám sát chặt chẽ việc thu hồi cũng như xử lý thuốc vi phạm. Các cơ sở khám chữa bệnh, nhà thuốc, cơ sở kinh doanh dược phẩm trên toàn quốc cũng được yêu cầu ngừng ngay việc kinh doanh, cấp phát và sử dụng thuốc Femancia; hoàn trả thuốc còn tồn lại cho nhà cung cấp theo đúng quy định.
Ngoài rút giấy đăng ký của loại thuốc ra khỏi danh mục các thuốc được cấp giấy đăng ký lưu hành tại Việt Nam, Cục Quản lý Dược cho biết thuốc Femanica sẽ không được sản xuất và lưu hành trên thị trường kể từ ngày 16/7.






























Bình luận của bạn