 Cục Quản lý Dược cung cấp các dấu hiệu nhận biết thuốc giả - Ảnh: Cục Quản lý Dược
Cục Quản lý Dược cung cấp các dấu hiệu nhận biết thuốc giả - Ảnh: Cục Quản lý Dược
Kem trẻ em Diệp Bảo bị thu hồi, tiêu hủy trên toàn quốc
Vụ bê bối sữa bột ở Pháp: Đã ngăn chặn sản phẩm nhiễm khuẩn vào Việt Nam
Thu hồi toàn quốc lô Dung dịch nhỏ mắt Tobradico vi phạm chất lượng
3 sản phẩm nước tẩy trang thương hiệu Bioderma bị thu hồi
Cục Quản lý Dược nhận được một số thông tin của Cơ quan Cảnh sát điều tra – Công An huyện Thạch Thất; Công ty TNHH AstraZeneca Việt Nam; Công ty TNHH Novartis Việt Nam; Văn phòng đại diện F.Hoffmann - La Roche Ltd tại Hà Nội, Văn phòng đại diện LesKaboratoires Servier tại Hà Nội về việc phát hiện một số lô thuốc giả, nghi ngờ giả, không rõ nguồn gốc có thông tin ghi trên nhãn (hình ảnh đính kèm) như sau:

Mặt trước và mặt sau của hộp thuốc Nexium 40mg - Ảnh: Cục Quản lý Dược
- Nexium 40mg, Enterik Kapli Pellet Tablet, AstraZeneca, (01) 08699786040045, (21) 3500000157639358; (17) SKT: 09.2024; (10) Parti no: 22B264. Trong mỗi hộp có 4 vỉ, mỗi vỉ 7 viên. Xem thêm hình ảnh chi tiết TẠI ĐÂY.
- Nexium 40mg, Enterik Kapli Pellet Tablet, AstraZeneca, số lô: 21H979, trong mỗi hộp có 4 vỉ, mỗi vỉ 7 viên (hình ảnh giống với hình ảnh của lô Parti no: 22B264 nêu trên).
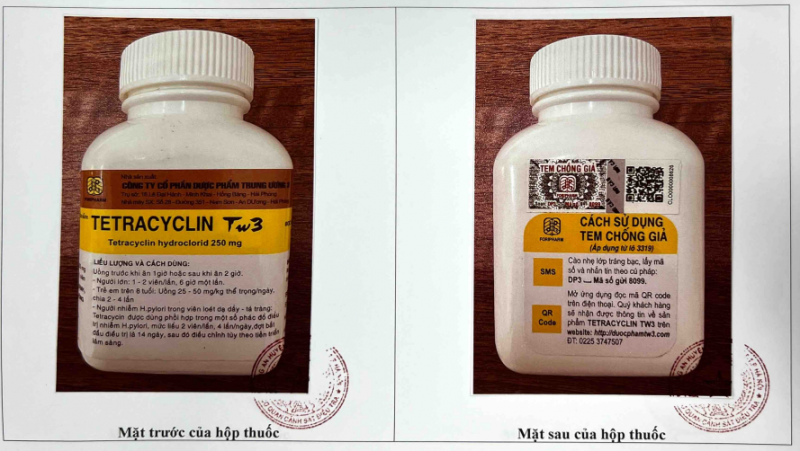
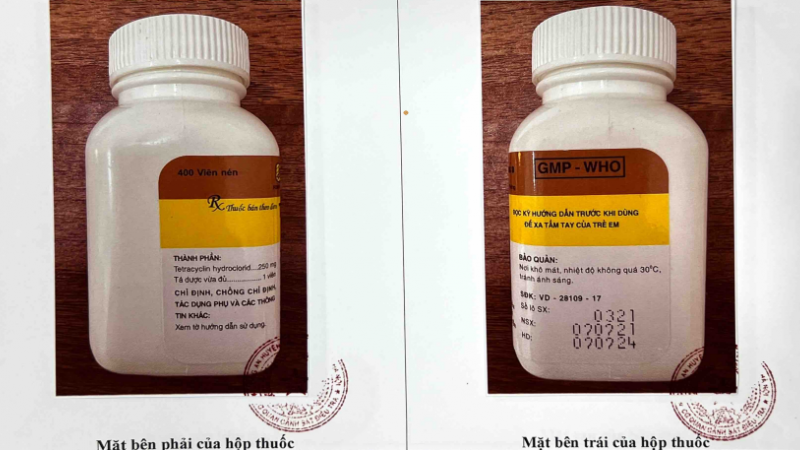
Mặt trước và mặt sau của hộp thuốc Tetracyclin Tw3 250mg - Ảnh: Cục Quản lý Dược
- Tetracyclin Tw3 250mg, SĐK: VD-28109-17, số lô SX: 0321, NSX: 02/02/2021, HD: 02/02/2024, nhà sản xuất: Công ty Cổ phần dược phẩm Trung ương 3, quy cách hộp 400 viên nén. Xem thêm hình ảnh chi tiết TẠI ĐÂY.
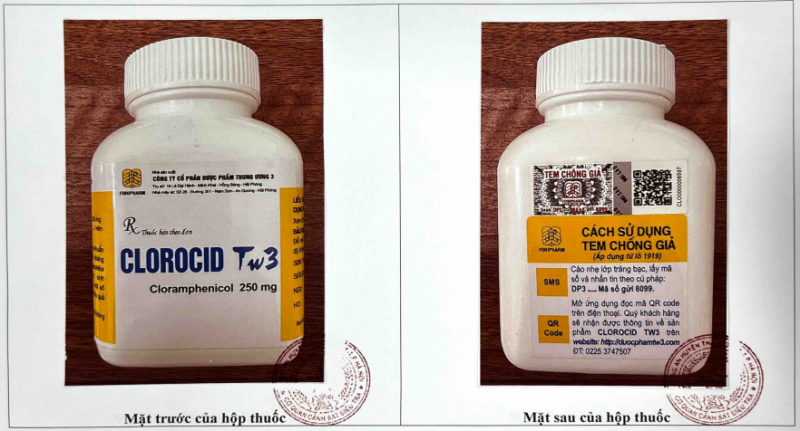
Mặt trước và mặt sau của hộp thuốc Clorocid Tw3 250mg - Ảnh: Cục Quản lý Dược
- Clorocid Tw3 250mg, SĐK: VD-25305-16, số lô SX: 0321, NSX: 07/07/2021, HD: 07/07/2024, nhà sản xuất: Công ty Cổ phần dược phẩm Trung ương 3, quy cách hộp 400 viên nén. Công ty CP Dược phẩm Trung ương 3 thông báo tới Cục Quản lý Dược từ 16/09/2019 đến 29/6/2022 (thời điểm Công ty thông báo), Công ty không tiến hành sản xuất lô thuốc nào đối với Clorocid Tw3, SĐK: VD-25305-16. Xem thêm hình ảnh chi tiết TẠI ĐÂY.
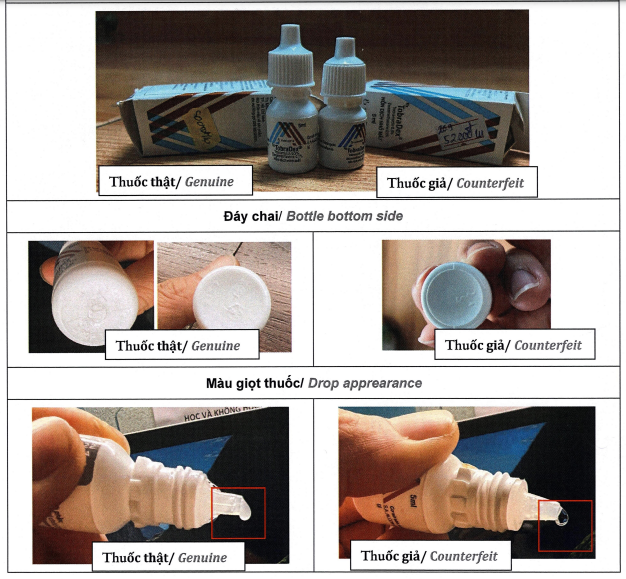
Hình ảnh so sánh thuốc TobraDex thật và giả - Ảnh: Cục Quản lý Dược
- TobraDex, hộp 1 lọ đếm giọt Droptainer 5ml, số lô: 22C10HB, ngày hết hạn/EXP: 10/03/2024, ngày sản xuất/MFD: 10/03/2022. Xem chi tiết các dấu hiệu phân biệt TẠI ĐÂY.

Mô tả điểm khác biệt trên thuốc giả Tecentriq 1200mg/20ml - Ảnh: Cục Quản lý Dược
- Tecentriq 1200mg/20ml (atezolizumab), số lô B0033B03, HSD: 02/09/24, code 10001437939658. Chi tiết đặc điểm phân biệt thuốc Tecentriq thật và giả TẠI ĐÂY.
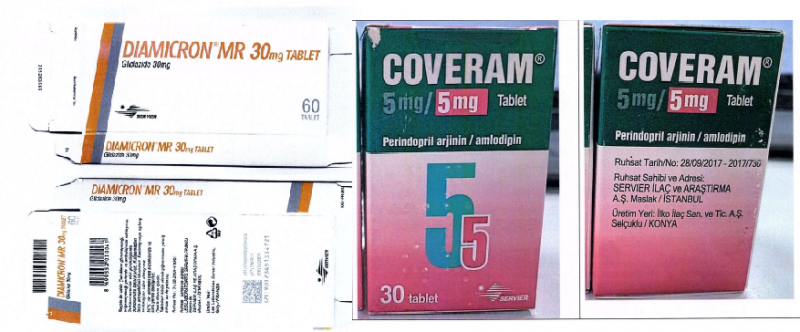
Hình ảnh 2 loại thuốc giả Diamicron MR 30mg và Coveram 5mg/5mg - Ảnh: Cục Quản lý Dược
- Diamicron MR 30mg, số lô: 695986, HSD: 09/2024.
- Coveram 5mg/5mg, số lô: 2170310010, HSD: 11/2024. Xem chi tiết mô tả 2 loại thuốc giả Diamicron MR 30mg và Coveram 5mg/5mg TẠI ĐÂY.
Để đảm bảo an toàn cho người sử dụng, Cục Quản lý Dược đề nghị Sở Y tế các tỉnh, thành phố trực thuộc Trung ương, Y tế các ngành:
- Thông báo cho các cơ sở kinh doanh, sử dụng thuốc không kinh doanh, phân phối và sử dụng các sản phẩm được liệt kê có các đặc điểm để phân biệt nêu trên, báo cáo cơ quan chức năng nếu phát hiện lô thuốc trên.
- Tăng cường việc thanh tra, kiểm tra hoạt động kinh doanh của các cơ sở kinh doanh dược trên địa bàn, tập trung việc kiểm tra đối với các sản phẩm có thông tin như mô tả nêu trên.
- Tiếp nhận và xác minh thông tin; Báo cáo Ban chỉ đạo 389 tỉnh, thành phố và phối hợp với các cơ quan chức năng liên quan kiểm tra xác minh, truy tìm nguồn gốc xuất xứ đối với các sản phẩm có thông tin như mô tả nêu trên nếu phát hiện trên địa bàn. Khẩn trương thanh tra, kiểm tra hoạt động kinh doanh thuốc đối với các cơ sở kinh doanh, sử dụng thuốc nêu trên; Xử lý nghiêm các trường hợp vi phạm và báo cáo kết quả về Cục Quản lý Dược.
Cục Quản lý Dược yêu cầu các công ty sản xuất, kinh doanh, nhập khẩu, phân phối liên quan đến các sản phẩm có thông tin như mô tả nêu trên: Cung cấp thông tin và phối hợp với Sở Y tế các tỉnh, thành phố và các cơ quan chức năng có liên quan trong việc truy tìm nguồn gốc đối với các sản phẩm có thông tin như mô tả nêu trên.
































Bình luận của bạn