



Trong hai năm 2020-2021, khi đại dịch COVID-19 lan tràn trên toàn cầu, nhiều nhà hoạch định chính sách y tế và giới công nghiệp dược đã dự đoán sẽ xảy ra tình trạng thiếu thuốc và vật tư y tế, đặc biệt các vật tư y tế sử dụng trong phòng chống dịch. Ngay từ tháng 11/2020, cách đây gần hai năm, Trường Y tế công cộng Bloomberg thuộc Đại học Johns Hopkins (Hoa Kỳ) đã có một đánh giá toàn diện về “Đại dịch và chuỗi cung ứng” cho chúng ta một cái nhìn toàn diện về một trong những vấn đề khẩn cấp của ngành y tế: Thiếu thuốc và đứt gãy nguồn cung ứng thuốc men, vật tư y tế trong đại dịch [1]. Thiếu thuốc là một mối nguy đe dọa đến sức khỏe cộng đồng và trong nhiều trường hợp ảnh hưởng nghiêm trọng đến tình trạng sức khỏe và tính mạng của người bệnh.
Các tác giả của bản báo cáo đã cho rằng “Đại dịch COVID-19 đã tạo ra nhu cầu thuốc và tình trạng bấp bênh chưa từng có tiền lệ trong sản xuất, cung ứng thuốc và cho thấy sự mong manh dễ đứt gẫy của hệ thống cung ứng thuốc Hoa Kỳ trong bối cảnh khủng hoảng y tế”.

Theo Hội Các dược sỹ hệ thống y tế Hoa Kỳ (ASHP: American Society of Health-System Pharmacists) việc thiếu thuốc có thể là hậu quả của sự kết hợp một loạt các yếu tố xuyên suốt quá trình sản xuất và cung ứng dược phẩm, bao gồm: cung ứng nguyên liệu dược (API: active pharmaceutical ingredient), sản xuất, quản lý theo quy chế, nhà phân phối/bán buôn, nhà bán lẻ, các tổ chức đấu thầu/mua thuốc, các cơ sở y tế và bệnh nhân/người tiêu dùng thuốc… Các yếu tố quan trọng khác là: mỗi một dược phẩm có một thị trường đặc thù riêng biệt, vấn đề quản lý sản xuất và chất lượng của cơ quan quản lý dược, năng lực sản xuất không đáp ứng với nhu cầu tăng vọt, phụ thuộc quyết định và chiến lược sản phẩm của doanh nghiệp, thiếu nguyên liệu và tá dược, các biện pháp hành chính về hạn chế cung ứng thuốc trong đại dịch… [2]
Ngày 19 tháng 5 năm 2022, Cơ quan quản lý Thực phẩm và Dược phẩm Hoa kỳ (FDA) đã ban hành dự thảo đầu tiên Hướng dẫn Kế hoạch quản lý nhằm giảm nhẹ khả năng thiếu thuốc và thúc giục giới công nghiệp dược góp ý để chính thức ban hành và áp dụng [3, 4]. Hướng dẫn này giúp cho các doanh nghiệp sản xuất dược phẩm, cung cấp nguyên liệu dược (API), tá dược và ngay cả bao bì dược phẩm… xây dựng kế hoạch xác định và đánh giá các rủi ro đối với việc sản xuất và cung ứng dược phẩm. FDA cho rằng kế hoạch quản lý rủi ro (RMP: Risk Management Plan) là một công cụ hữu ích cho các doanh nghiệp dược. FDA cũng hối thúc các nhà sản xuất dược phẩm, kể cả các nhà sản xuất theo hợp đồng, cần thiết lập kế hoạch quản lý rủi ro để kiểm soát các mối nguy liên quan đến việc đứt gẫy quá trình cung ứng thuốc và thiếu thuốc để xây dựng được một chuỗi cung ứng dược phẩm vững mạnh và linh hoạt. Bản dự thảo Hướng dẫn cũng trình bày một khung hành động (action framework) cho tất cả các bên liên quan (stakeholders) khi thiết lập kế hoạch quản lý rủi ro phù hợp với Hướng dẫn quản lý rủi ro chất lượng của ICH-Q9 (ICH Q9 Quality Risk Management).




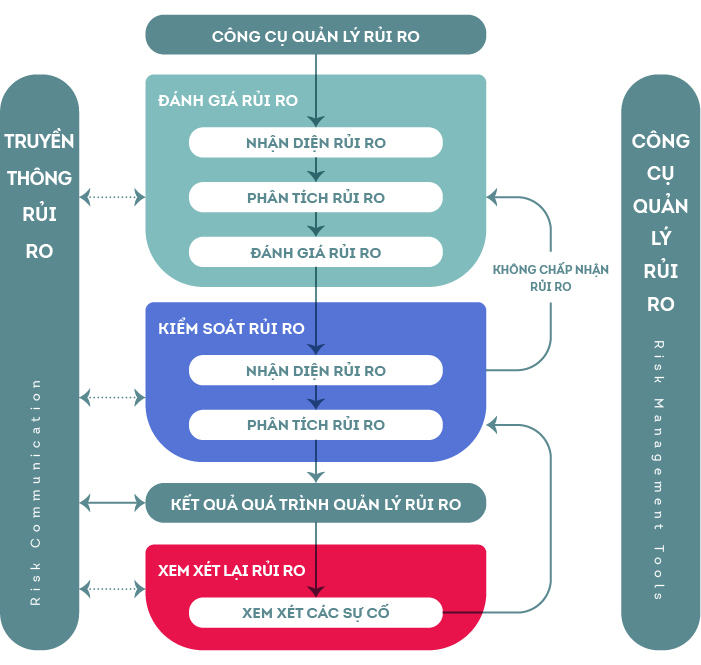
Để xây dựng Kế hoạch đánh giá rủi ro thiếu thuốc, FDA khuyến cáo các nhà sản xuất dược phẩm cần tiến hành: (i) Đánh giá rủi ro, (ii) Xây dựng chiến lược kiểm soát rủi ro và (iii) Thiết lập chương trình kiểm tra, đánh giá lại rủi ro.
Quá trình đánh giá rủi ro bao gồm: (i) Xác định đúng rủi ro có thể dẫn đến thiếu thuốc, (ii) Phân tích rủi ro bao gồm cả việc xác định những sai lầm trong quá khứ có thể tránh được để không gây ra thiếu thuốc và (iii) Đánh giá rủi ro, bao gồm cả việc xác định xác xuất có thể xẩy ra và tác động của nó. Kết thúc giai đoạn đánh giá rủi ro, có thể xác định được rủi ro/nguy cơ, phân tích, đánh giá và xác định thứ tự ưu tiên giải quyết các rủi ro/nguy cơ và điều quan trọng là xác định mối nguy lớn nhất gây nên sự đứt gẫy chuỗi cung ứng dược phẩm.
Giai đoạn tiếp theo của RMP là thiết lập chương trình kiểm soát rủi ro. Cần có kế hoạch giảm thiểu rủi ro (risk reduction) và chấp nhận rủi ro (risk acceptance). Giảm thiểu rủi ro là thiết lập chiến lược để giảm nhẹ hoặc loại trừ rủi ro đã được xác định, ví dụ xây dựng kế hoạch dự trữ nguyên vật liệu cho quá trình sản xuất, kiểm soát chuỗi cung ứng nguyên vật liệu, xây dựng mối quan hệ chặt chẽ với các đối tác cung ứng và xác định các nhà cung ứng thay thế. Sau khi tiến hành hành động giảm thiểu rủi ro, phải định kỳ đánh giá lại các rủi ro và xác định hiệu quả của của hành động giảm thiểu rủi ro. Chấp nhận rủi ro là xác định rủi ro còn lại (remaining risk) có thể được chấp nhận hay không. Kết thúc giai đoạn kiểm soát rủi ro cần phải xây dụng một bản báo cáo về chiến lược đánh giá và kiểm soát rủi ro.
Bước cuối cùng của kế hoạch quản lý rủi ro là kiểm tra, đánh giá lại rủi ro (risk review). FDA khuyến nghị công việc này cần phải tiến hành hàng năm (annual review) và có thể từng giai đoạn thời gian nếu cần, và qua đó có thể sửa đổi Kế hoạch quản lý rủi ro đối với toàn bộ “vòng đời” (life cycle) của thuốc. Bản kế hoạch này phải bao gồm các kinh nghiệm, bài học đã được rút ra, các nguyên nhân cốt lõi (root cause) của việc đứt gẫy chuỗi cung ứng, đánh giá và cải thiện quá trình thông tin với cơ quan quản lý…

Hội Các dược sỹ hệ thống y tế Hoa Kỳ (ASHP), đại diện cho các dược sỹ tham gia vào hệ thống chăm sóc sức khỏe nhân dân cũng đã ban hành Hướng dẫn Quản lý hiện tượng thiếu thuốc điều trị cho bệnh nhân.


ASHP cho rằng việc đứt gẫy chuỗi cung ứng dược phẩm có tác động rất lớn đến hệ thống chăm sóc sức khỏe của quốc gia. Tất cả các tổ chức, cơ quan liên quan có thể tham gia ngăn chặn hiện tượng thiếu thuốc bằng cách thiết lập một kế hoạnh quản lý rủi ro để đối phó trước khi hiện tượng này xảy ra. Mặc dù trên thực tế khó có thể ngăn chặn được tình trạng này nhưng có thể giảm nhẹ tác động đến bệnh nhân, hệ thống y tế và ngăn chặn được sự gia tăng của vấn đề thiếu thuốc. Các yếu tố bảo đảm thành công là: thu thập đầy đủ các thông tin, làm việc nhóm để đánh giá và thiết lập các phương án để lựa chọn (option), năng lực đối phó và lựa chọn các giải pháp, hoạt động truyền thông với các nhà cung cấp, với bệnh nhân, với các nhà quản lý và với phương tiện truyền thông đại chúng.






















Bình luận của bạn