 Cục Quản lý Dược (Bộ Y tế) ghi nhận tình trạng lưu hành thuốc giả cùng các sản phẩm mỹ phẩm có thành phần không trùng khớp với hồ sơ công bố trên thị trường - Ảnh minh họa.
Cục Quản lý Dược (Bộ Y tế) ghi nhận tình trạng lưu hành thuốc giả cùng các sản phẩm mỹ phẩm có thành phần không trùng khớp với hồ sơ công bố trên thị trường - Ảnh minh họa.
Thu hồi hai lô mỹ phẩm Ori Women Pluss và LD Perfume Oil kém chất lượng
Cảnh báo sữa tắm gội Lactacyd Baby Extra Milky giả đang lưu hành
Phát hiện thuốc ngủ Lexomil® 6mg giả mạo đang lưu hành trên thị trường
Phát hiện thêm thuốc giãn phế quản giả đang lưu hành trên thị trường
Thu hồi 5 sản phẩm của Công ty TNHH sản xuất và thương mại mỹ phẩm Đăng Dương
Ngày 12/9, Cục Quản lý Dược ban hành quyết định đình chỉ lưu hành và thu hồi trên toàn quốc 5 sản phẩm mỹ phẩm của Công ty TNHH sản xuất và thương mại mỹ phẩm Đăng Dương (TP. Hồ Chí Minh) – Tổ chức chịu trách nhiệm đưa sản phẩm ra thị trường, bao gồm:
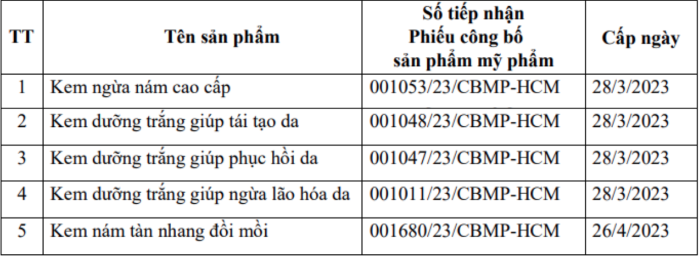
Nguyên nhân thu hồi được xác định là các sản phẩm có thành phần công thức không đúng so với hồ sơ đã công bố. Cục Quản lý Dược đề nghị Sở Y tế các tỉnh, thành phố thông báo cho các cơ sở kinh doanh, sử dụng mỹ phẩm trên địa bàn ngừng ngay việc kinh doanh, sử dụng 5 sản phẩm nêu trên và trả lại cơ sở cung ứng sản phẩm; Tiến hành thu hồi, tiêu hủy 5 sản phẩm vi phạm nêu trên; Kiểm tra, giám sát các đơn vị thực hiện thông báo này; Xử lý các đơn vị vi phạm theo quy định hiện hành.
Đồng thời yêu cầu doanh nghiệp thu hồi toàn bộ sản phẩm vi phạm, gửi thông báo đến nơi phân phối, đồng thời báo cáo kết quả thu hồi trước ngày 15/9/2025.
1 sản phẩm và 3 lô mỹ phẩm của Công ty MTV sản xuất dược - mỹ phẩm GAMMA
Cùng ngày 12/9, Cục Quản lý Dược cũng thông báo đình chỉ lưu hành, thu hồi và tiêu hủy sản phẩm mỹ phẩm Vinatid (Số tiếp nhận Phiếu công bố sản phẩm mỹ phẩm: 004149/20/CBMP-HCM; Cấp ngày 05/10/2020) của Công ty TNHH MTV sản xuất dược – mỹ phẩm Gamma (TP. Hồ Chí Minh) do có thành phần công thức không đúng với thành phần công thức trong hồ sơ đã công bố.
Bên cạnh đó, 3 lô mỹ phẩm khác của công ty này cũng bị thu hồi vì công dụng không đúng với hồ sơ đã công bố. Cụ thể:
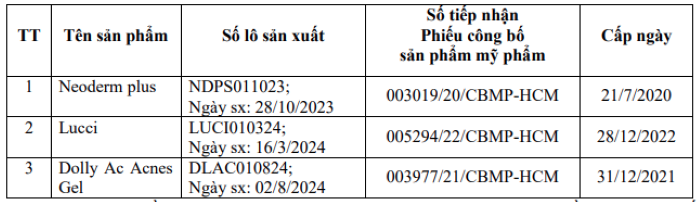
Cục Quản lý Dược đề nghị Sở Y tế các địa phương thông báo tới cơ sở kinh doanh, người sử dụng ngừng lưu hành sản phẩm Vinatid và 3 lô mỹ phẩm vi phạm nêu trên, đồng thời giám sát chặt chẽ việc thu hồi. Doanh nghiệp phải hoàn tất báo cáo thu hồi trước ngày 30/9/2025.
Cảnh báo thuốc nhỏ mắt nghi giả của Novartis Việt Nam
Ngày 15/9, Cục Quản lý Dược tiếp nhận báo cáo của Công ty TNHH Novartis Việt Nam về nhiều trường hợp nghi ngờ thuốc giả gồm: Tobrex 5ml (lô VEE98C, VEE90A), Maxitrol 5ml (lô VFD09A) và TobraDex 5ml (lô VHN07A). Trong đó, Novartis Việt Nam đã xác minh sản phẩm Tobrex 5ml, lô VEE90A là thuốc giả, các lô còn lại đang bị nghi ngờ.
Cục Quản lý Dược yêu cầu người dân không mua, bán, sử dụng các lô thuốc trên và khẩn trương thông báo cho cơ quan chức năng nếu phát hiện lưu hành trên thị trường. Đồng thời, nhấn mạnh chỉ nên mua thuốc tại cơ sở kinh doanh hợp pháp để tránh rủi ro.
Thuốc trị loãng xương Aclasta bị phát hiện lô nghi giả
Trước đó, ngày 10/9, Cục Quản lý Dược đã phát đi cảnh báo về sản phẩm Aclasta – thuốc điều trị loãng xương do Công ty Sandoz Việt Nam đăng ký. Công ty này báo cáo đã phát hiện lô hàng mang số KHBY7, sản xuất 08/2024, hạn dùng 07/2027 không phải do nhà sản xuất chính thức cung cấp, nghi là thuốc giả.

Hình ảnh thuốc Aclasta chính hãng (trái) và sản phẩm nghi ngờ là hàng giả (phải) - Ảnh: Cục Quản lý Dược.
Cục Quản lý Dược yêu cầu các Sở Y tế thông báo rộng rãi đến người dân: không mua/bán hoặc sử dụng thuốc Aclasta có ngày sản xuất từ sau 05/2024 nhưng vẫn mang logo Novartis, do các lô chính thức sau thời điểm này đã thay đổi nhận diện bao bì sang logo Sandoz.
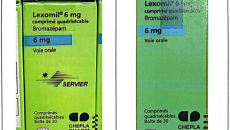
Ngoài 2 loại thuốc nhỏ mắt Tobrex, thuốc trị loãng xương Aclasta bị nghi làm giả nêu trên, Cục Quản lý Dược cũng ghi nhận trường hợp thuốc ngủ Lexomil® 6mg, do Công ty Cheplapharm Arzneimottel GmbH sở hữu. Lực lượng chức năng TP.HCM vừa thu giữ lô thuốc số F3193F01, hạn dùng tháng 12/2027.
Nhà sản xuất xác nhận đây là thuốc giả, được sản xuất cho thị trường Pháp và chưa từng được nhập khẩu vào Việt Nam. Đặc biệt, Lexomil® 6 mg chưa có số đăng ký lưu hành trong nước, nên mọi hoạt động mua bán, sử dụng đều là trái phép.




























Bình luận của bạn