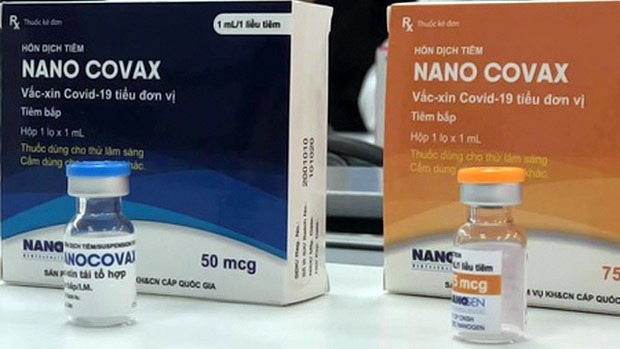
 Bộ Y tế chưa đồng ý cấp phép khẩn cấp cho vaccine Nano Covax để đưa vào sử dụng
Bộ Y tế chưa đồng ý cấp phép khẩn cấp cho vaccine Nano Covax để đưa vào sử dụng
Việt Nam đề nghị Đức hợp tác chuyển giao công nghệ sản xuất vaccine COVID-19
Một trường hợp tử vong sau 39 giờ tiêm vaccine COVID-19 ở Đông Anh
Tiêm vaccine COVID-19 cần lưu ý những điều gì?
Bộ Y tế hướng dẫn khám sàng lọc tiêm chủng vaccine phòng COVID-19
Theo đó, đại diện Bộ Y tế đã cho biết một vaccine muốn được đưa vào sử dụng khẩn cấp vẫn cần phải trải qua đầy đủ các bước, quy trình kiểm nghiệm, đánh giá để đảm bảo sự an toàn. Vaccine bắt buộc phải thử nghiệm lâm sàng trên người với 3 giai đoạn, trong đó, giai đoạn 3 là quan trọng nhất.
Ở giai đoạn 3 này, vaccine sẽ được đưa vào thử nghiệm trên quy mô lớn để đánh giá lại tính an toàn và hiệu quả bảo vệ. Kết quả thu được sẽ quyết định việc vaccine đó có được phê duyệt để triển khai tiêm chủng rộng rãi hay không. Các loại vaccine sau khi đã được phê duyệt vẫn phải liên tục bổ sung, cập nhật các thông tin, dữ liệu liên quan đến tính an toàn, hiệu quả trong quá trình sử dụng.
Trên trang suckhoedoisong.vn, đại diện Bộ Y tế khẳng định việc đánh giá tính sinh miễn dịch trong giai đoạn 1 và 2 không phải là yếu tố quyết định cho việc phê duyệt khẩn cấp.
Chỉ có kết quả thử nghiệm lâm sàng giai đoạn 3 mới là yếu tố quyết định để đánh giá vaccine này có hiệu quả bảo vệ, có làm giảm nguy cơ mắc COVID-19 hay giảm nhẹ tình trạng bệnh hay không.
Đại diện Bộ Y tế cũng cho biết việc cấp phép khẩn cấp sử dụng vaccine COVID-19 hiện nay là do điều kiện dịch bệnh nên chưa đủ thời gian để theo dõi tính hiệu quả của vaccine như thông lệ. Tuy nhiên, vaccine muốn xin cấp phép vẫn cần phải thực hiện đầy đủ quy trình đánh giá hiệu quả bảo vệ.
Cho đến thời điểm hiện tại, Việt Nam mới chỉ phê duyệt có điều kiện 4 loại vaccine COVID-19 gồm: AstraZeneca, Sputnik V, Pfizer và Sinopharm. Cả 4 vaccine này đều được phê duyệt khi đã có dữ liệu thử nghiệm lâm sàng 3 giai đoạn.
Theo ông Nguyễn Ngô Quang - Phó Cục trưởng Cục Khoa học công nghệ và đào tạo (Bộ Y tế), kiến nghị của Nanogen là "quá sớm và nóng vội" khi chưa đầy đủ các dữ liệu về mặt khoa học. Vaccine Nano Covax đang thử nghiệm giai đoạn 3 trên 1.000 người, đây là số lượng nhỏ, chưa mang tính cộng đồng so với số lượng hàng trăm triệu người sử dụng sau này.
Ông khẳng định: “Để có đủ căn cứ khoa học đánh giá cần phải theo dõi sau tiêm mũi 1 sau 36 ngày, 45 ngày và 56 ngày. Trên cơ sở đó mới đủ tiêu chuẩn đánh giá tính sinh miễn dịch và hiệu lực bảo vệ ra sao. Như vậy ít nhất phải sau 2 tháng và thử nghiệm trên cỡ mẫu này mới có thể đánh giá”.











 Nên đọc
Nên đọc



















Bình luận của bạn