
PGS.TS Trần Đáng - Chủ tịch Hiệp hội TPCN Việt Nam (VAFF)
I. ĐIỀU KIỆN ĐỂ SẢN XUẤT TPCN:
1. Nguy cơ:
(1) Ai sản xuất TPCN cũng được, công thức, thành phần còn tùy tiện.
(2) Quy định như hiện hành là chưa đủ.
2. Cần thiết:
(1) Điều kiện về cơ sở
(2) Điều kiện về trang thiết bị
(3) Điều kiện về con người
(4) Điều kiện về quy trình công nghệ
(5) Điều kiện về cơ sở thí nghiệm.

II. ĐIỀU KIỆN ĐỂ SẢN PHẨM ĐƯỢC LƯU HÀNH:
1. Nguy cơ:
(1) Chỉ dựa vào công bố hợp quy hoặc công bố phù hợp quy định ATTP.
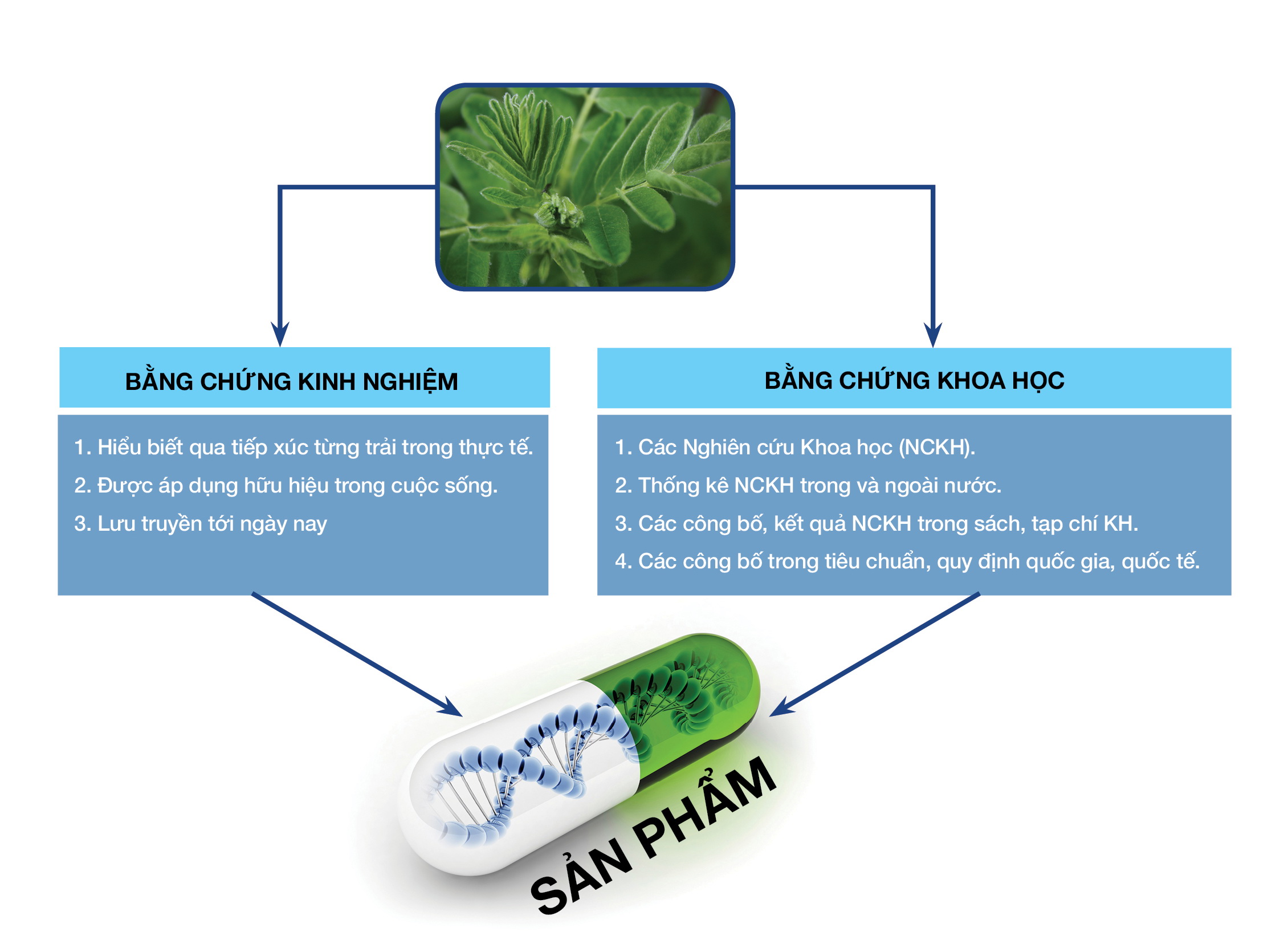
(2) Đánh giá tính hiệu quả (công bố về tác dụng với sức khỏe của sản phẩm chủ yếu dựa vào bằng chứng kinh nghiệm (Hiểu biết qua tiếp xúc, từng trải trong thực tế được áp dụng hữu hiệu trong cuộc sống)
2. Cần thiết:
2.1. Đảm bảo chất lượng (mức độ tập hợp các đặc tính của sản phẩm) đáp ứng các yêu cầu:
(1) Thành phần nguyên liệu
(2) Hàm lượng thành phần, hoạt chất.
(3) Tính ổn định của thành phần, hoạt chất.
(4) Độ tinh khiết.
2.2. Đảm bảo tính an toàn (không có các mối nguy gây hại tới sức khỏe NTD không thể chấp nhận được):
(1) Đánh giá bằng chứng kinh nghiệm (Experiential Evidence).
(2) Đánh giá bằng chứng khoa học (Scientific Evidence):
+ Đánh giá nguyên liệu, hàm lượng hoạt chất, độ tinh khiết.
+ Đánh giá các mối nguy.
+ Đánh giá độc tính trên động vật và trên lâm sàng:
· Độc cấp tính
· Độc mạn tính
· Khả năng hình thành khối u
· Khả năng gây nhiễm độc hoặc đột biến gen
· Khả năng gây quái thai
· Khả năng gây RLCN, khả năng hấp thu, bài tiết, tích trữ …
· Khả năng gây dị ứng.
2.3. Đảm bảo tính hiệu quả (Tác dụng với sức khỏe: Tác dụng được khoa học chứng minh có khả năng cải thiện sức khỏe, giảm thiểu nguy cơ và tác hại của bệnh tật. Nó không phải là một trị liệu y học nhằm mục đích điều trị hay cứu chữa bệnh tật).
(1) Khẳng định tác dụng ngăn ngừa hoặc giảm thiểu các nguy cơ gây bệnh khi xảy ra sự thiếu hụt các chất. Nếu bổ sung TPCN sẽ khắc phục được sự thiếu hụt trên.
(2) Khẳng định tác động vào cấu trúc và chức năng sinh lý của cơ thể bởi các thành phần hoặc toàn bộ sản phẩm (Đánh giá bằng các chỉ tiêu giải phẫu – sinh lý – sinh hóa với các nghiên cứu dịch tễ học mô tả và dịch tễ học can thiệp).
(3) Thử nghiệm trên động vật.
(4) Nghiên cứu can thiệp trên người.
2.4. Ghi nhãn theo quy định của TPCN
(1) Tên sản phẩm
(2) Tên, địa chỉ của nhà sản xuất
(3) Định lượng
(4) Ngày sản xuất, hạn sử dụng, hạn bảo quản
(5) Xuất xứ
(6) Thành phần, thành phần định lượng
(7) Công dụng
(8) Hướng dẫn sử dụng, bảo quản
(9) Thông tin, cảnh báo an toàn – sức khỏe
2.5. Phải được công bố hợp quy hoặc công bố phù hợp quy định an toàn thực phẩm tại VFA.
Tham khảo của Mỹ: Certificate of Free Sale của FDA: phải đạt tiêu chuẩn 3P:
(1) GMP (Cơ sở nhà xưởng, thiết bị máy móc, quy trình công nghệ, nhân viên sản xuất …)
(2) GAP (Nguyên liệu, cây trồng)
(3) GLP (Nghiên cứu trong phòng thí nghiệm. Đánh giá tính chất lượng, an toàn và hiệu quả).
III. QUY ĐỊNH ĐÁNH GIÁ TÍNH CHẤT LƯỢNG – TÍNH AN TOÀN – TÍNH HIỆU QUẢ.
1. Nguy cơ:
(1) Mới chỉ dựa vào bằng chứng kinh nghiệm (Dựa trên cơ sở YHCT).
(2) Mới chỉ kiểm nghiệm được chỉ tiêu an toàn (Vi khuẩn, kim loại nặng, nấm mốc).
2. Cần thiết:
(1) Thống nhất về định nghĩa, tiêu chí, phương pháp đánh giá.
(2) Bằng chứng khoa học (Scientific Evidence): là những chứng minh sự công bố về tính an toàn, tính chất lượng, tính hiệu quả của sản phẩm là đúng, chính xác, khoa học, khách quan): Bao gồm:
+ Các nghiên cứu khoa học (nghiên cứu dịch tễ học mô tả, dịch tễ học can thiệp và dịch tễ học thực nghiệm).
+ Thống kê các công trình NCKH trên thế giới và trong nước.
+ Các công bố, kết quả NCKH đã đăng tải trong sách, tạp chí khoa học.
+ Các công bố trong các tiêu chuẩn và quy định của Quốc gia và quốc tế (Codex).
IV. CÔNG BỐ (CLAIMS) CỦA DOANH NGHIỆP:
1. Nguy cơ:
(1) Thái quá về tác dụng với sức khỏe của sản phẩm.
(2) Thả nổi về đối tượng sử dụng (Trẻ sơ sinh, phụ nữ có thai …)
2. Cần thiết:
(1) Quy định về công bố tác dụng với sức khỏe của sản phẩm. Cấm với trẻ em
£ 2 tuổi như quy định của Codex, Mỹ, Canada, Pháp ....
(2) Quy định đối tượng sử dụng, chú ý các đối tượng đặc biệt (phụ nữ có thai, sơ sinh, người già, người có nguy cơ sức khỏe và người có bệnh).
(3) Quy định phải cảnh báo sức khỏe.
V. QUẢNG CÁO:
1. Nguy cơ:
(1) Quảng cáo thái quá như thuốc, sai lệch với hồ sơ công bố tại VFA (50% sai lệch).
(2) Tổ chức quảng cáo còn tùy tiện, tiếp nhận quảng cáo chưa chú ý nội dung quảng cáo đã đăng ký tại VFA.
2. Cần thiết:
(1) Quy định cụ thể quy chế quảng cáo.
(2) Kiểm tra, thanh tra, xử lý nghiêm, thích hợp.
VI. THÀNH PHẦN CỦA TPCN:
1. Nguy cơ:
(1) Công thức phối hợp các thành phần còn tùy tiện.
(2) Đưa cả thành phần tân dược làm thành phần TPCN.
2. Cần thiết:
(1) Quy định các thành phần của TPCN.
(2) Quy định các thành phần cấm, các chất cấm và dược thảo cấm.
VII. KIỂM SOÁT HÀNG GIẢ, KÉM CHẤT LƯỢNG, NHẬP LẬU, XÁCH TAY.
1. Nguy cơ:
(1) TPCN giả, kém chất lượng, nhập lậu, xách tay còn lưu hành trên thị trường.
(2) Ảnh hưởng tới sức khỏe người tiêu dùng.
(3) Ảnh hưởng ngành TPCN.
2. Cần thiết:
(1) Có định nghĩa, tiêu chí, phương pháp kiểm soát thực phẩm giả, kém chất lượng.
(2) Cấm lưu hành các sản phẩm nhập lậu, xách tay.
(3) Kiểm tra, thanh tra, xử lý nghiêm, thích hợp.
VIII. ĐÁNH GIÁ NGUY CƠ SẢN PHẨM LƯU THÔNG TRÊN THỊ TRƯỜNG:
1. Nguy cơ:
(1) Sản phẩm lưu thông trên thị trường còn bị thả nổi.
(2) Ảnh hưởng sức khỏe người tiêu dùng và thị trường TPCN.
2. Cần thiết:
(1) Có chương trình và đầu tư đánh giá nguy cơ sản phẩm TPCN lưu thông trên thị trường (chương trình phân tích nguy cơ).
(2) Có quy định trong Luật: Doanh nghiệp và cơ quan quản lý Nhà nước phải có chương trình phân tích nguy cơ.




























Bình luận của bạn