 Bệnh xơ cứng teo cơ một bên là một bệnh hiếm gặp nhưng nguy hiểm
Bệnh xơ cứng teo cơ một bên là một bệnh hiếm gặp nhưng nguy hiểm
FDA yêu cầu cập nhật thông tin về mật độ vú khi chụp nhũ ảnh
FDA liên tục cảnh báo, thu hồi sản phẩm nhỏ mắt
FDA cảnh báo 7 công ty bán TPCN với tuyên bố “điều trị bệnh tim mạch”
FDA đề xuất định nghĩa mới về "thực phẩm lành mạnh"
Theo thông tin từ đại diện của Cơ quan Quản lý Thực phẩm và Dược phẩm Mỹ (FDA), một loại thuốc điều trị bệnh xơ cứng teo cơ một bên (hay hội chứng ALS - Amyotrophic Lateral Sclerosis) đang được nghiên cứu của Biogen (công ty dược phẩm chuyên sản xuất thuốc điều trị các bệnh liên quan đến thần kinh của Mỹ) có thể có “lợi ích lâm sàng” đối với một dạng bệnh hiếm gặp và nguy hiểm, dù loại thuốc này đã thất bại trong một thử nghiệm lâm sàng giai đoạn cuối vào năm ngoái.
Theo đó, đại diện FDA và một nhóm cố vấn (không tới từ FDA) đã họp vào ngày 22/3, nhằm thảo luận về việc có nên đề xuất phê duyệt nhanh thuốc tofersen của Biogen để điều trị một dạng di truyền hiếm gặp của bệnh xơ cứng teo cơ một bên hay không. Chỉ định phê duyệt nhanh của FDA cho phép phê duyệt thuốc nhanh hơn, thường là cho các tình trạng nghiêm trọng nhưng chưa đáp ứng được nhu cầu y tế, chưa có thuốc điều trị tối ưu.
Trong buổi thảo luận, các chuyên gia đã xem xét kết quả các thử nghiệm liên quan tới hiệu quả và độ an toàn của tofersen, đồng thời bỏ phiếu xem liệu có thể chứng minh được thuốc có mang tới lợi ích lâm sàng cho những bệnh nhân mắc dạng hội chứng ALS hiếm gặp hay không.
Theo đại diện FDA, loại thuốc này không cho thấy hiệu quả điều trị tích cực, có ý nghĩa thống kê với toàn bộ người mắc ALS. Cụ thể, loại thuốc này không thể làm chậm sự tiến triển của ALS trong thử nghiệm giai đoạn ba, theo kết quả được công bố vào tháng 10/2022. Các nhà khoa học cũng chưa xác định được liệu thuốc có ảnh hưởng gì tới toàn bộ những người mắc hội chứng ALS hay không.
Tuy nhiên, dữ liệu chỉ ra rằng việc sử dụng thuốc có mục tiêu đã được chứng minh có thể làm giảm “một dấu ấn sinh học (biomarker- một chỉ số đo lường được mức độ nghiêm trọng hoặc sự hiện diện của một số trạng thái bệnh) đã được chứng minh có liên quan đến sự tiến triển và tiên lượng bệnh xơ cứng teo cơ một bên”. Đại diện FDA cũng cho rằng thuốc có thể cho thấy “lợi ích lâm sàng với thời gian điều trị lâu hơn”.
Hội chứng ALS hiện vẫn chưa có thuốc điều trị tối ưu
Biogen lưu ý rằng thuốc tofersen có ảnh hưởng tới một phiên bản đột biến của protein SOD1. Hiện tượng protein tích tụ đến mức đáng lo ngại ở những người bị đột biến một gene cụ thể có thể làm hỏng hệ thần kinh, dẫn đến sự phát triển của hội chứng ALS.
Theo đó, nghiên cứu chỉ ra rằng người bệnh dùng tofersen đã giảm được nồng độ protein SOD1 trong khoảng từ 26 - 38% so với những bệnh nhân dùng giả dược. Các nhà khoa học cũng phát hiện ra rằng tofersen có thể làm giảm lượng protein chuỗi nhẹ neurofilament (NfL). Lượng protein này “tương quan với mức độ nghiêm trọng, tốc độ tiến triển của bệnh và khả năng sống sót của người mắc hội chứng ALS,” đại diện FDA cho biết.
Đại hiện FDA nhấn mạnh “việc làm giảm tổn thương tế bào thần kinh, cụ thể là mức giảm NfL thuyết phục như vậy có thể làm chậm quá trình suy giảm chức năng lâm sàng”.
FDA cho biết họ đã vạch ra 2 phương án tiềm năng để xem xét trong phiên thảo luận. Phương án đầu tiên là tiếp tục đề xuất phê duyệt nhanh, dựa trên hiệu quả giảm lượng NfL của tofersen ở người mắc hội chứng ALS. Phương án thứ hai là đề xuất phê duyệt thuốc hoàn toàn, dựa trên dữ liệu có sẵn và kết quả từ một nghiên cứu mở rộng đang được thực hiện.
Theo Biogen, chỉ có vài nghìn người trên thế giới được chẩn đoán mắc loại đột biến này - tức là khoảng 2% trong số 168.000 người mắc hội chứng ALS trên toàn thế giới. Tuy nhiên, nếu loại thuốc này được chấp thuận, chúng có thể mở ra hướng nghiên cứu mới đầy hứa hẹn trong việc nhắm mục tiêu tới nguyên nhân gây ra hội chứng ALS. Các nhà nghiên cứu từ Viện Y tế Quốc gia (Mỹ) ước tính rằng các trường hợp mắc hội chứng ALS trên toàn thế giới sẽ tăng gần 70%, lên tới khoảng 376.000 trường hợp trong tương lai.
Do đó, nếu được chấp thuận, thuốc của Biogen có thể trở thành loại thuốc đầu tiên nhắm vào nguyên nhân di truyền của bệnh xơ cứng teo cơ một bên, hay còn được gọi là bệnh Lou Gehrig.
Đây là một bệnh thần kinh - cơ tiến triển và có thể gây tử vong, khiến các tế bào thần kinh trong tủy sống và não bị phá vỡ theo thời gian. Bệnh có thể khiến các cơ bị co và gây chuột rút, cản trở đáng kể khả năng vận động của người bệnh, ví dụ như gây khó nuốt, khó thở và cuối cùng gây tê liệt, thậm chí tử vong. Bệnh thường ảnh hưởng đến những người từ 40 - 70 tuổi.
Đầu tháng 3/2023, Hiệp hội Hội chứng ALS (Mỹ) cho biết họ đã gửi ý kiến đến ban cố vấn của FDA, thúc giục đề xuất phê duyệt hoàn toàn cho thuốc tofersen. Đơn vị này cho rằng thuốc đáp ứng tất cả các yêu cầu để có thể được phê duyệt nhanh.
TS. Neil Thakur từ Hiệp hội Hội chứng ALS (ALS Association) cho biết: “ALS liên quan tới đột biến SOD1 là một dạng đặc biệt hiếm gặp và nguy hiểm của một căn bệnh vốn đã hiếm gặp và có sức tàn phá khủng khiếp. Chúng tôi hiểu được nhu cầu cấp thiết về các phương pháp điều trị ALS mới. Dựa trên dữ liệu có sẵn ở giai đoạn này, chúng tôi tin rằng tofersen đáp ứng tất cả các điều kiện cần thiết để có thể được phê duyệt nhanh. Cụ thể, đây là thuốc điều trị một tình trạng nghiêm trọng; Mang lại lợi thế đáng kể so với các liệu pháp hiện có; Đã được chứng minh có thể có tác dụng lâm sàng”.
Hiện FDA đã chấp nhận đơn đăng ký phê duyệt tofersen của Biogen vào tháng 7/2022. Dự kiến quyết định cuối cùng sẽ được đưa ra vào ngày 25/4 tới đây.



















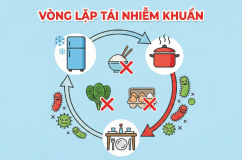







Bình luận của bạn